
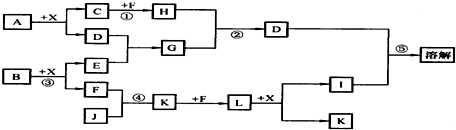
 ,
,分析 A、B均是由两种短周期元素组成的化合物,X为无色液体,D具有两性,且A与X反应得到D与C,C为气态氢化物,应是A发生水解反应,可推知X为H2O、D为Al(OH)3,由元素守恒可知A中含有Al元素.D能溶解在I中,I为强酸或强碱,B与水反应得到F,气态氢化物J与F反应得到K,K与F反应得到L,L与水反应得到I与K,中学中工业制备硝酸符合转化关系,可推知J为NH3,F为O2,K为NO,L为NO2,I为HNO3,则B为Na2O2,则E为NaOH、G为NaAlO2.C、J是同周期元素的气态氢化物,即C为第二周期氢化物,与氧气反应生成H,H与偏铝酸钠反应得到Al(OH)3,可推知H为CO2,C为CH4,故A中还含有C元素,则A为Al4C3,其中Al元素质量分数为75%,符合题意,据此解答.
解答 解:A、B均是由两种短周期元素组成的化合物,X为无色液体,D具有两性,且A与X反应得到D与C,C为气态氢化物,应是A发生水解反应,可推知X为H2O、D为Al(OH)3,由元素守恒可知A中含有Al元素.D能溶解在I中,I为强酸或强碱,B与水反应得到F,气态氢化物J与F反应得到K,K与F反应得到L,L与水反应得到I与K,中学中工业制备硝酸符合转化关系,可推知J为NH3,F为O2,K为NO,L为NO2,I为HNO3,则B为Na2O2,则E为NaOH、G为NaAlO2.C、J是同周期元素的气态氢化物,即C为第二周期氢化物,与氧气反应生成H,H与偏铝酸钠反应得到Al(OH)3,可推知H为CO2,C为CH4,故A中还含有C元素,则A为Al4C3,其中Al元素质量分数为75%,符合题意.
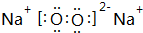
(1)由上述分析可知,A为Al4C3,C为CH4,B为Na2O2,电子式为 ,
,
故答案为:Al4C3;CH4; ;
;
(2)反应③为2Na2O2+2H2O=4NaOH+O2,反应中Na2O2起氧化剂、还原剂作用,氧元素化合价从-1价变化为0价,-2价,反应中每生成lmolF(O2)转移电子物质的量为1mol×2=2mol,转移电子数为2mol×6.02×1023mol-1=1.204×1024,
故答案为:1.204×1024;
(3)反应④是氨气的催化氧化反应,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)反应②中足量的二氧化碳气体通入偏铝酸钠溶液中发生的反应,反应的离子方程式为:AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;
反应⑤是氢氧化铝在硝酸中溶解的反应,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;
(5)反应①是甲烷燃烧生成二氧化碳和水的反应,每1.00g CH4与足量的F(O2)作用,恢复到25℃水为液体,放出55.6kJ热量,则1mol甲烷燃烧放热为55.6kJ×$\frac{1mol×16g/mol}{1.00g}$=889.6KJ,故反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ•mol-1.
点评 本题考查无机物推断,基本属于猜测验证型推断,注意以“X为无色液体,D具有两性”为突破口,结合转化关系中连续反应进行推断,需要学生熟练掌握元素化合物知识与中学常见化学工业,难度较大.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$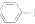
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10 mL0.1 mol•L-1Na2CO3溶液逐滴滴加到10 mlL0.1 mol•L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | 物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 | |
| C. | 向0.1mol•L-1的FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4溶液不褪色,说明FeCl3只有氧化性,无法被氧化剂氧化 | |
| D. | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3浓溶液,可观察到大量淡黄色沉淀与少量白色沉淀,说明Ksp(AgCl)>Ksp(AgBr) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )| A. | 甲池中电解质溶液的pH值减小 | |
| B. | 乙池中CuSO4溶液的浓度不变 | |
| C. | 甲池中理论上消耗空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| D. | 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O═CO32-+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
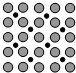 ①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①②③ | B. | ④③②① | C. | ④①③② | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若mXa+与nYb-符合题目要求,则m+a=n-b | |
| B. | 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定小于HnY | |
| C. | X,Y一定不是相邻周期元素 | |
| D. | 若X,Y处于同一周期且X离子所带电荷多于Y离子,则离子半径一定为:X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com