
下列指定反应的离子方程式正确的是
A.氯化铝溶液中加入过量的氨水:Al3++4 NH3·H2O=AlO2-+4 NH4+
B.稀硝酸中加入过量铁粉:Fe+4H++NO3- = Fe3++NO↑+2H2O
C.二氧化锰与浓盐酸混合加热:MnO2+4H++2Cl- △ Mn2++ Cl2↑+2H2O
D.石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为: Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g) 2XY3(g) △H=-92.6kJ·mol-1
2XY3(g) △H=-92.6kJ·mol-1
起始时各物质物质的量如下表所示:
容器 编号 | 起始时各物质物质的量/mol | ||
X2 | Y2 | XY3 | |
① | 1 | 3 | 0 |
② | 0.6 | 1.8 | 0.8 |
达到平衡后,①容器中XY3的物质的量为0.5mol。下列叙述正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,容器②中XY3的物质的量浓度为2mol·L—1
C.容器①中反应达到平衡时放出的热量为23.15 kJ
D.容器②中反应达到平衡时放出热量
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:实验题
(15分)溴化钙在医药上用作中枢神经抑制药,实验室用“尿素法”制备溴化钙的主要流程如下:
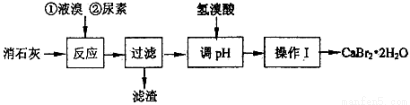
溴化钙的部分溶解度数值如下:
温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(1)6Ca(OH)2+6Br2 50~70℃ 5CaBr2+6H2O+Ca(BrO3)2,每生成1 mol Ca(BrO3)2转移电子的物质的量为 ;50~70℃时,尿素[CO(NH2)2]将生成的Ca(BrO3)2还原为CaBr2,尿素被氧化为N2,该反应的化学方程式为 。
(2)过滤所需的玻璃仪器有玻璃棒、,。
(3)加入氢溴酸调pH的作用是。
(4)操作I包括、、过滤、、干燥。
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案。
限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
葛根素具有降血压等作用,其结构简式如下图,下列有关说法正确的是

A.该物质在一定条件下能发生消去反应、加成反应、取代反应
B.葛根素的分子式为C21H22O9
C.该物质一个分子中含有5个手性碳原子
D.一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是()
A.对硝基甲苯的结构简式: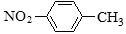 B.CH2F2的电子式:
B.CH2F2的电子式:
C.中子数为16的硫原子: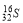 D.乙炔的最简式:CH
D.乙炔的最简式:CH
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A、温度相同、体积相同的O2(g)和N2(g)分子数相同
B、等温等压下,SO2气体与CO2气体的密度之比等于16∶11
C、温度和容积相同的两气罐中分别盛有5mol O2(g)和2 mol N2(g),两容积中的压强之比等于5∶2
D、等温等压条件下, 5 molO2(g)和2 molH2 (g)的体积之比等于5∶2
查看答案和解析>>
科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:实验题
(16分)“向海洋进军”,已成为世界许多国家发展的战略口号,海水中通常含有较多的Ca2+、Mg2+、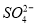 等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
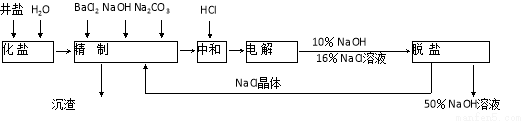
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为 ;
(2)电解过程的总反应的化学方程式_________________________________________。
(3)电解槽阳极产物可用于_____________________________(至少写出两种用途)。
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为: 。
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
NaOH /g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
NaCl/ g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
根据上述数据,脱盐工序中利用通过 、 (填操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值。下列说法正确的是(用到的相对原子质量:H 1 O16 Al27)
A.18g 2H2O含有10NA个电子
B.1mol苯含有6NA个C-H键
C.常温常压下,22. 4L NH3约含有NA个NH3分子
D.27 g铝片投入足量浓H2SO4中生成1.5NA个SO2分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com