
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液氯、盐酸B.生石灰、白磷、石膏
C.干冰、铁、硫酸D.空气、氮气、胆矾
科目:高中化学 来源: 题型:
【题目】可逆反应 2A (气) + 3B (气)![]() 2C (气) + D(气),在四种不同条件下反应速率最快的是
2C (气) + D(气),在四种不同条件下反应速率最快的是
A. VA = 0.5mol/(L·min) B. VB = 0.6mol/(L·min)
C. VC = 0.35mol/(L·min) D. VD = 0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中,加入2molA和1molB,发生反应如下;2A(气)+B(气) ![]() 3C(气)+D(气)当反应达到平衡时,C的浓度为Wmol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L是
3C(气)+D(气)当反应达到平衡时,C的浓度为Wmol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L是
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molA+1molB+1molC D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol I2(g)和2 mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
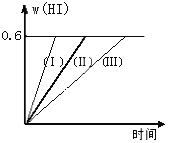
(1)达平衡时,I2(g)的物质的量浓度为____________________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是____________,则乙条件可能是_____________ 。(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;⑤恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入氢氧化钠溶液呈___色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________这种改变的方向移动,
2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入氢氧化钠溶液呈___色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________这种改变的方向移动,
(2)在KMnO4与H2C2O4反应中,可通过测定_________________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:__________________;此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A. KMnO4溶液中的H+起催化作用
B. 生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D. 在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
①该实验进行的目的是_____________淀粉溶液的作用是____________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,试推测该实验结论: ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 将饱和氯化铁溶液逐滴加入煮沸的蒸馏水中制备氢氧化铁胶体:Fe3+ + 3H2O ![]() Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B. 向FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++ Br2 + 4Cl-
C. 将NaHCO3溶液与过量的Ca(OH)2溶液混合:HCO3- + OH-+ Ca2+ = CaCO3↓+ H2O
D. 用KIO3氧化酸性溶液中的KI:5I- + IO3- + 3H2O = 3I2 + 6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A.酸性:H2SO4>H3PO4 B.热稳定性:Na2CO3>NaHCO3
C.碱性:NaOH>Mg(OH)2 D.非金属性:Cl>Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式,并回答相关问题:
(1)草酸使酸性高锰酸钾溶液褪色的离子方程式为____________________________________;紫色溶液的褪色速率先慢后快,然后又变慢,褪色速率加快的原因是__________________________________。
(2)0.1 mol/L硫代硫酸钠与0.1mol/L稀硫酸反应的离子方程式为_____________________________,实验现象为_______________________________。
(3)①H2O2在常温下分解比较慢,但在MnO2催化下可以剧烈分解,并且剧烈放热。写出反应的化学方程式:________________________________。
②实验室常用过氧化钡与稀硫酸反应制取H2O2,写出反应的化学方程式:_______________________。
③Na2O2与水的反应历程实际上是Na2O2先和水反应生成H2O2,然后H2O2再分解产生氧气。②和③的实验说明H2O2保存在酸性溶液中比在碱性溶液中_________(填“稳定”“不稳定”或“一样稳定”),说明_________(填离子符号)能够催化H2O2分解。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com