
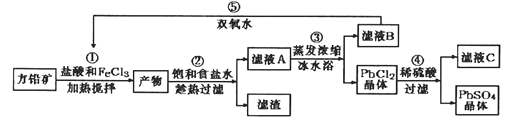
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)①中生成淡黄色沉淀的离子方程式是________________________________________________,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____________________。
(2)用化学平衡移动的原理解释③中使用冰水浴的原因是__________________
(3)上述流程中可循环利用的物质有_______________。
(4)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:
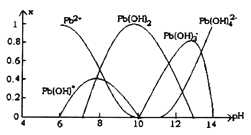
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
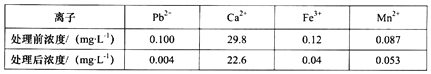
由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_________________________________________。
【答案】 PbS+2Fe3++2Cl-= PbCl2+2Fe2++S 抑制Fe3+、Pb2+的水解 用冰水浴使反应PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出 盐酸和氯化铁 Pb(OH)3+OH= Pb(OH)42 加入试剂,Pb2+的浓度转化率为(0.10.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.120.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好
PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出 盐酸和氯化铁 Pb(OH)3+OH= Pb(OH)42 加入试剂,Pb2+的浓度转化率为(0.10.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.120.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好
【解析】往方铅矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于PbCl2(s)+2Cl(aq)PbCl42△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液A含有PbCl42、Cl、Fe2+、Fe3+等,滤液A蒸发浓缩,冷水浴中冷却,利于平衡逆向进行,析出PbCl2晶体,滤液B中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅晶体,滤液C中含有HCl。
(1). FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成,反应方程式为:2FeCl3+PbS=PbCl2+S+2FeCl2,离子方程式为:PbS+2Fe3++2Cl-= PbCl2+2Fe2++S;Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7,流程中加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是抑制Fe3+、Pb2+的水解,故答案为:PbS+2Fe3++2Cl-= PbCl2+2Fe2++S;抑制Fe3+、Pb2+的水解;
(2).用冰水浴使PbCl2(s)+2Cl(aq)PbCl42△H>0逆向移动,使PbCl42转化PbCl2析出,故答案为:用冰水浴使反应PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
(3). 过氧化氢将滤液B中Fe2+氧化为Fe3+,再循环利用,C溶液中含有HCl,也可以循环利用,故答案为:盐酸和氯化铁;
(4). ①. pH≥13时,Pb(OH) 3浓度减小,Pb(OH) 42浓度增大,Pb(OH) 3与氢氧根离子结合为Pb(OH) 42,反应离子方程式为:Pb(OH) 3 +OH= Pb(OH) 42,故答案为:Pb(OH) 3 +OH= Pb(OH) 42;
②.加入试剂,Pb2+的浓度转化率为(0.10.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.120.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好,故答案为:加入试剂,Pb2+的浓度转化率为(0.10.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.120.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.铜片在稀硫酸和NaNO3混合溶液中可溶解
B.常温常压下,46gNO2和N2O4混合气体共含有3mol原子
C.光纤通讯中制造光纤的基本原料是SiO2
D.光照氯水有气泡,逸出该气体是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠及其化合物说法正确的是
A. Na与O2在不同反应条件下产物不同
B. Na2O2和Na2O与水反应产物相同
C. Na2O2中阴、阳离子的个数比为1∶1
D. 将一小块金属钠投入到硫酸铜溶液,有红色物质析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SO2、Cl2均能使品红溶液永久性褪色
B. NH4HCO3晶体、固体碘受热均能变成气体都是因为升华
C. 铁分别与氯气、硫反应都生成含三价铁的化合物
D. OH-与Mg2+、Cu2+均因为生成难溶物而不能在溶液中大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题: 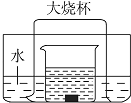
(1)实验过程中,观察到的主要现象是: ①;②;③;④ .
(2)用该装置做铜与浓硝酸反应的实验,最突出的优点是 .
(3)若要验证最终得到的气体生成物,最简便的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国三峡工程所提供的清洁、廉价、强劲、可再生的水电,相当于每年燃烧几百万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制( )
A.温室效应和酸雨
B.赤潮
C.白色污染
D.破坏臭氧层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】引起环境污染的原因不正确的是
A. 重金属、农药和难分解有机物、含N、P的污水等会造成水体污染
B. 装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C. SO2、NO2和CO2都会导致酸雨的形成
D. CO2的大量排放会造成温室效应的加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.煤是各种芳香烃组成的混合物
B.煤燃烧时,会产生大量二氧化硫、氮氧化合物、碳氧化合物和烟尘等污染物
C.煤是以单质碳为主的复杂混合物
D.以煤为主要原料,可以合成甲醇,但不可以加工成高级汽油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com