
| A. |  实验室室制取并收集NH3 | B. | 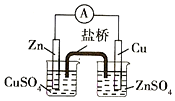 构成铜锌原电池 | ||
| C. |  检查装置气密性 | D. | 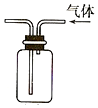 利用排空气法收集CO2 |
分析 A.收集氨气时集气瓶口不能密封;
B.左侧Zn与硫酸铜反应,不能形成原电池;
C.关闭止水夹,利用液差法可检验气密性;
D.二氧化碳的密度比空气的密度大.
解答 解:A.收集氨气时集气瓶口不能密封,应塞棉花团防止与空气对流,故A错误;
B.左侧Zn与硫酸铜反应,不能形成原电池,应将电解质互换,故B错误;
C.关闭止水夹,长颈漏斗与烧瓶中液面差在一定时间内保持不变,则气密性良好,故C正确;
D.二氧化碳的密度比空气的密度大,图中应长导管进气,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、原电池、气体的收集、气密性检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的水溶液一定比弱电解质溶液的导电能力强 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不溶性盐都是弱电解质,可溶性盐都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
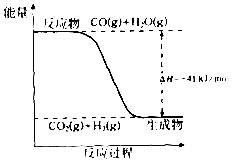 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
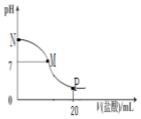 向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )
向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中存在c(Cl-)=c(NH4+)=c(OH-)=c(H+) | |
| D. | p点处的溶液中存在:2 c(NH4+)+2c(NH3•H2O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g/mol | B. | 100g | C. | 55g/mol | D. | 55g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工业中有重要应用,已知以下几个反应:
硼及其化合物在工业中有重要应用,已知以下几个反应: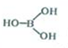 ,反应Ⅰ中相关化学键键能数据如下:
,反应Ⅰ中相关化学键键能数据如下:| 化学键 | H-O | H-Cl | B-O | B-Cl |
| E(KJ•mol-1) | 465 | 431 | 809 | 427 |
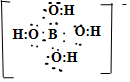 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431kJ•mol-1 | B. | 649kJ•mol-1 | C. | 896kJ•mol-1 | D. | 946kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com