
【题目】向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
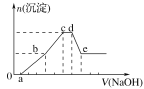
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在b~c段加入NaOH溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
C.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO2-+2H2O
D.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如图:
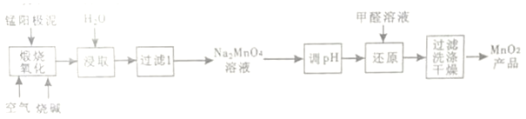
(1)“煅烧氧化”时,1molMnO煅烧完全转化为Na2MnO4失去电子___mol;
(2)为提高Na2MnO4的浸取速率,可采取的措施有___(列举2点)
(3)“调pH”是将溶液pH调至约为10,写出用pH试纸测定溶液pH的操作_____。
(4)MnO2煅烧反应的化学方程式为_____。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1.准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2.然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是___;产品中MnO2的质量分数为ω(MnO2)=___(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2Cu+Ag2O=Cu2O+2Ag可设计成如图所示的原电池。普通水泥在固化过程中其自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家利用该电池发明了电动势法测水泥的初凝时间。下列有关说法正确的是( )
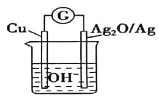
A.电子流动方向从Cu→Ag2O→电解质溶液→Cu,形成闭合回路
B.正极的电极反应式为Ag2O+2H++2e-=2Ag+H2O
C.2molCu与1molAg2O的总能量低于1molCu2O与2molAg的总能量
D.电池工作时,OH-向Cu极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数NA的叙述中不正确的是( )
A.1mol NaHSO4固体所含的阳离子数目为NA
B.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
C.标准状况下,22.4L HF含有电子数为8NA
D.60g石英晶体中含有的Si-O键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种极易溶于水且几乎不与冷水反应的黄绿色气体(沸点11℃),实验室制备纯净ClO2溶液的装置如图所示:

已知下列反应:NaClO3+HCl→NaCl+ClO2+Cl2+H2O;NaClO2+HCl→NaCl+ClO2+H2O;NaClO2+Cl2→NaCl+ClO2(均未配平)。下列说法正确的是
A.a中通入的N2可用CO2或SO2代替B.b中NaClO2可用饱和食盐水代替
C.c中广口瓶最好放在冰水浴中冷却D.d中吸收尾气后只生成一种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:____。
(2)实验②的化学反应中转移电子的物质的量是____。
Ⅱ.(3)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是____(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
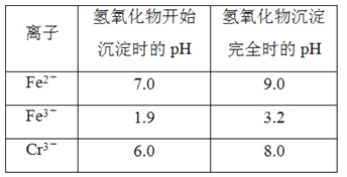
(1)某含铬废水处理的主要流程如图所示:
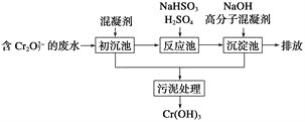
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
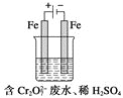
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=[(CO2)·(H2)]/[(CO)·(H2O)]在不同的温度下该反应的平衡常数如下表所示:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
C. 某温度下,如果平衡浓度符合下列关系式:(CO2)/3(CO)=(H2O)/5(H2),判断此时的温度是1 000 ℃
D. 该反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com