
科目:高中化学 来源:不详 题型:填空题
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们的空间构型相同,碳原子均可以采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp3杂化,所有原子均共面 |
 量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题: =1.03、μBCl3=0。由此可知,PF3分子是 构型,BCl3分子是 构型。
=1.03、μBCl3=0。由此可知,PF3分子是 构型,BCl3分子是 构型。 对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。 :在洁净铁(可用于合成氨
:在洁净铁(可用于合成氨
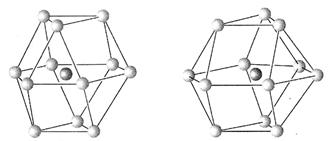
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
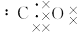 ,下列叙述,正确的是( )
,下列叙述,正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热碘化氢气体使之分解只需克服分子间作用力 |
| B.氯化氢溶于水能电离出H+、Cl-,所发氯化氢是离子化合物 |
| C.氧气与臭氧相互转化属于化学变化 |
| D.碘晶体和碘蒸气是同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com