
 A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属.请回答下列问题
A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属.请回答下列问题分析 A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,所以A是质子为6的碳,C是质子数为6的氧,D为质子数为14的硅,而A、B、C同周期,所以B是氮,A与D、B与F分别同主族,所F是磷,E是生活中用量最大的金属为铁,由此分析解答.
解答 解:A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,所以A是质子为6的碳,C是质子数为6的氧,D为质子数为14的硅,而A、B、C同周期,所以B是氮,A与D、B与F分别同主族,所F是磷,E是生活中用量最大的金属为铁,
(1)铁比较稳定的离子是铁离子,核外电子排布式为:ls22s22p63s23p63d5或[Ar]3d5,故答案为:ls22s22p63s23p63d5或[Ar]3d5;
(2)同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳3个电子,为半满稳定状态,能量较低,其第一电离能高于O氧元素,故第一电离能C<O<N,A、B、C的简单氢化物中最易汽化的物质,也就是沸点最低的,其中水和氨分子之间存在氢键,所以最易汽化的物质为:CH4,故答案为:C<O<N;CH4;
(3)C与D形成的物质是二氧化硅,该晶体类型是原子晶体,IT产业中该晶体用于生产光导纤维,故答案为:原子晶体;光导纤维;
(4)由C、N、O三种元素中的一种或两种元素形成的分子中,有的互为等电子体,如N2和CO,它们的结构式为:N≡N和C≡O,故答案为:N2和CO;N≡N和C≡O;
(5)氮的单质晶胞与CO2的相似,所以晶胞中氮气的个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以一个晶胞中含B的原子个数为4×2=8,氨气是三角锥形,故答案为:8;三角锥形;
(6)C与E形成的晶体的部分结构如图,而图中还有第三种元素,所以不是该晶胞,该晶体中铁与氧原子个数之比为:1:1,所以化学式
为:FeO;不是,与E最近且等距离的C有x、y、z 平面上各4个,所以构成
正八面体,故答案为:不是;FeO;正八面体;CH4.
点评 本题考查了第一电离能的比较、晶胞计算、电子式等,题目涉及的知识点较多,综合性较强,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CH≡C一CH2CH3 丁炔 | B. | CH2=CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 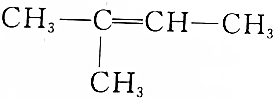 2-甲基丁烯 | D. | 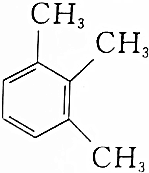 1,2,3-三甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
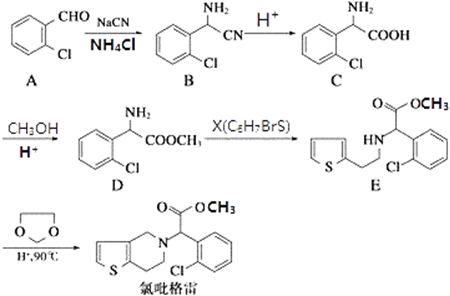

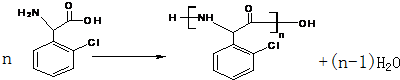 .(不需要写反应条件)
.(不需要写反应条件) ②
②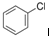 中氯原子较难水解,物质A(
中氯原子较难水解,物质A(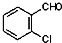 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
、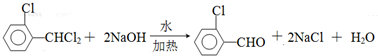 .
.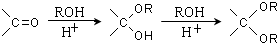
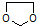 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2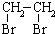
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:l | C. | 1:2 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c | B. | b>a>c | C. | c>b>a | D. | b>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 | |
| B. | 室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 | |
| C. | 室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 | |
| D. | 相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6+Cl2→C2H5Cl+HCl | B. | CH2═CH2+H2O→CH3CH2OH | ||
| C. |  +HO-NO2→ +HO-NO2→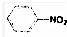 +H2O +H2O | D. | CH3CH2Cl+NaOH→CH2═CH2+NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.
氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com