
| A. | 甲烷是正四面体结构,性质活泼,常温下能与强酸、强碱发生剧烈反应 | |
| B. | 乙烯是通过石油裂解得到的,属于不饱和烃 | |
| C. | 苯与氢气、液溴、浓硝酸的反应类型相同 | |
| D. | 乙酸又名醋酸,其官能团是醚基,可以与乙醇发生反应生成乙酸乙酯 |
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.8 g D2O含有NA个中子 | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 5.35 g NH4Cl固体中含有N-H键的个数为0.4NA | |
| D. | 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 含有5种官能团 | |
| B. | 分子式为C9H9O6 | |
| C. | 可以发生取代、加成、消去、氧化反应 | |
| D. | 核磁共振氢谱具有6个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
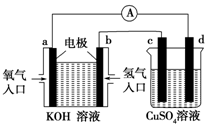 (1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式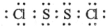 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g 分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | Na2O2与H2O的反应中每生成0.1molO2,转移电子数目为0.4NA | |
| C. | 常温常压下,1.7g NH3所含电子数为0.8NA | |
| D. | 标准状况下,11.2L NO与11.2LO2混合,原子总数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
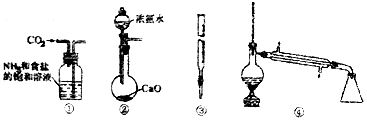
| A. | 装置①可用于模拟侯氏制碱法制取碳酸氢钠 | |
| B. | 装置②可用于制备少量NH3 | |
| C. | 装置③可用于准确取一定体积酸性KMnO4标准溶液 | |
| D. | 装置④常用于分离互不相溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.
现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.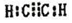 (写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.
(写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(2)(5) | C. | (2)(3)(5) | D. | (2)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
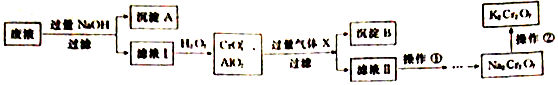
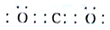 (填电子式)
(填电子式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com