
【题目】如图所示,食盐晶体由钠离子和氯离子构成。已知食盐的M=58.5g·mol-1,食盐的密度是2.2g·cm-3,阿伏加德罗常数为6.0×1023mol-1,在食盐晶体中两个距离最近的钠离子中心间的距离最接近下列哪个数据( )
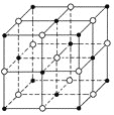
A.3.0×10-8cmB.3.5×10-8cmC.4.0×10-8cmD.5.0×10-8cm
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)___________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越__________。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________________(可用分数表示)。
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I已知下列热化学方程式:
①H2(g)+![]() O2(g)═H2O(l);△H=-285.8kJmol-1
O2(g)═H2O(l);△H=-285.8kJmol-1
②H2(g)+![]() O2(g)═H2O(g);△H=-241.8kJmol-1
O2(g)═H2O(g);△H=-241.8kJmol-1
③CO(g)═C(s)+![]() O2(g);△H=+110.5kJmol-1
O2(g);△H=+110.5kJmol-1
④C(s)+O2(g)═CO2(g);△H=-393.5kJmol-1
回答下列问题:
(1)上述反应中属于放热反应的是_________________
(2)H2的燃烧热△H=___________________
(3)燃烧10gH2生成液态水,放出的热量为________________
(4)表示CO燃烧热的热化学方程式为.________________
II已知:(1)P4(s,白磷)+5O2(g)==P4O10(s)△H1=-2983.2kJ/mol
(2)P(s,红磷)+ ![]() O2(g)=
O2(g)= ![]() P4O10(s) △H1=-738.5kJ/mol,则白磷转化为红磷的热化学方程式_________________。相同的状况下,能量较低的是_________________;白磷的稳定性比红磷_________________(填“高”或“低”)
P4O10(s) △H1=-738.5kJ/mol,则白磷转化为红磷的热化学方程式_________________。相同的状况下,能量较低的是_________________;白磷的稳定性比红磷_________________(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
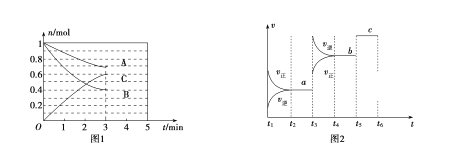
(1)该反应的化学方程式为__________________,此反应平衡常数的表达式为K=________。
(2)从开始到最初达到平衡,C的平均反应速率v(C)=________________。3min时,A的转化率=________%。该反应的![]() ________0。(填“
________0。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
(3)对于该反应改变某些条件,化学反应速率及化学平衡状态可能会发生变化,请回答:
①恒温恒容充入惰性气体,平衡______移动(填“正向”、“逆向”或“不”,下同)
②恒温恒压充入惰性气体,平衡______移动,化学反应速率_______(填“加快”或“减慢”)
③升高温度,平衡______移动。
(4)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是_______,t5时刻改变的外界条件是_______。
②a、b、c三个阶段中,C的体积分数最大的是________,
③a、b、c三个阶段的平衡常数分别用K1、K2、K3表示则:K1、K2、K3 之间的关系为___________(用“![]() ”、“
”、“![]() ”或“
”或“![]() ”连接)。
”连接)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关含氯物质的说法不正确的是
A.向新制氯水中加入少量碳酸钙粉末能增强溶液的漂白能力
B.向NaClO溶液中通入少量的CO2的离子方程式:CO2+2ClO-+H2O=2HClO+CO32-(已知酸性:H2CO3>HClO>HCO3-)
C.向Na2CO3溶液中通入足量的Cl2的离子方程式:2Cl2+CO32-+H2O=CO2+2Cl-+2HClO
D.室温下,向NaOH溶液中通入Cl2至溶液呈中性时,相关粒子浓度满足:c(Na+)=2c(ClO-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.

②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。

①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
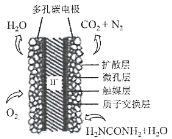
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
Ⅰ(1).某兴趣小组为研究原电池原理,设计如图装置。a和b不连接时,烧杯中发生反应的现象是___________________________。
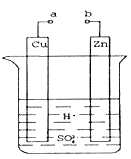
(2)a和b用导线连接,Cu极为原电池___________ (填“正”或“负”)极,电极反应式是___________ ,发生__________(填“氧化”或“还原”)反应。
(3)将a与直流电源的正极相连并把Cu换成石墨电极,b与直流电源的负极相连,则石墨电极反应式 ______________________,该过程的总反应方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com