
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+2H2O+2e-=Mn(OH)2+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
分析 根据电池总反应式为:Zn+MnO2+H2O═ZnO+Mn(OH)2,可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═ZnO+H2O,MnO2为原电池的正极,发生还原反应,正极反应为MnO2+2H2O+2e-═Mn(OH)2+2OH-,以此解答该题.
解答 解:A、根据总反应可知Zn失去电子被氧化,为原电池的负极,故A正确;
B、根据电池总反应式为:Zn+MnO2+H2O═ZnO+Mn(OH)2,可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═ZnO+H2O,MnO2为原电池的正极,发生还原反应,正极反应为MnO2+2H2O+2e-═Mn(OH)2+2OH-,故B正确;
C、原电池中,电子由负极经外电路流向正极,故C错误;
D、负极反应为Zn-2e-+2OH-═ZnO+H2O,外电路中每通过O.2mol电子,消耗的Zn的物质的量为0.1mol,质量为0.1mol×65g/mol=6.5g,所以锌的质量理论上减少6.5 g,故D正确.
故选C.
点评 本题考查化学电源的工作原理,题目难度不大,注意电极反应方程式的书写和判断.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
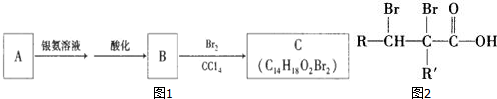 有机物A为茉莉香型香料.
有机物A为茉莉香型香料.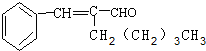 .
.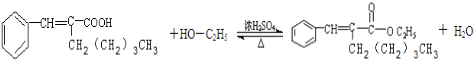 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
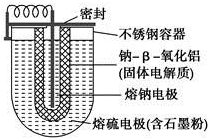 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为| A. | 外室熔融硫中添加石墨粉主要是为了增强导电性 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时阳极反应式为8S-16e-═nS8 | |
| D. | 充电时钠极与外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C2H4 | B. | C2H4和C3H4 | C. | C2H4和C2H6 | D. | C3H6和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-O键的极性比N-O键的极性大 | |
| B. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | 上述四种元素的原子半径大小为W<X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
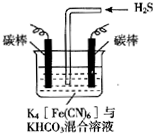 电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-=[Fe(CN)6]3- | |
| B. | 电解过程中阴极区溶液的pH变大 | |
| C. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| D. | 通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com