
分析 X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,X、Y为金属元素,此处显然X是Be;X与W的最外层电子数之和为9,W的最外层电子数为:9-2=7,为ⅤⅡA族元素;Y与Z的最外层电子数之和为9,Y为金属元素,Y的单质可与NaOH溶液反应,Y为Al,X、Y、Z、W是原子序数依次增大的短周期主族元素,W为ⅤⅡA族元素为Cl元素,则Z最外层电子数为9-3=6,为S元素,根据元素周期律的递变规律和对应物质的性质解答.
(1)Z为硫元素,核外有16个电子,分三层排布;
(2)同一周期从左向右,原子半径逐渐减小;
(3)Y为铝,工业上采用电解氧化铝的方法制取铝单质;
(4)X是Be,Y为铝,X与Y的化学性质相似,根据铝的性质书写单质X与NaOH浓溶液反应的化学方程式.
解答 解:(1)X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,X、Y为金属元素,此处显然X是Be;X与W的最外层电子数之和为9,W的最外层电子数为:9-2=7,为ⅤⅡA族元素;Y与Z的最外层电子数之和为9,Y为金属元素,Y的单质可与NaOH溶液反应,Y为Al,X、Y、Z、W是原子序数依次增大的短周期主族元素,W为ⅤⅡA族元素为Cl元素,则Z最外层电子数为9-3=6,为S元素,核外电子数等于其质子数,核外有16个电子,原子结构示意图为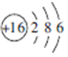 ,
,
故答案为: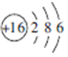 ;
;
(2)Y、Z、W分别为Al、S、Cl,属于第三周期,原子序数逐渐增大,同一周期从左向右,原子半径逐渐减小,所以半径为C1<S<A1,
故答案为:C1<S<A1;
(3)Y为铝,电解铝是目前广泛使用的金属,工业上用电解氧化铝制取金属铝,因氧化铝熔点高,用冰晶石作为氧化铝的助熔剂,反应为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
故答案为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(4)X是Be,Y为铝,铝和碱液反应生成偏铝酸盐和氢气,X与Y的化学性质相似,所以单质X与NaOH浓溶液反应的化学方程式是:Be+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$ Na2BeO2+H2↑,
故答案为:Be+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$ Na2BeO2+H2↑.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意限制条件“X、Y为金属元素”,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 刚玉、红宝石主要成分是氧化铝,陶瓷,分子筛主要成分是有机物高分子化合物 | |
| B. | 石油原油的脱水,有色玻璃、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体 | |
| C. | 碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应 | |
| D. | 风化、钝化、皂化、焰色反应都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3对饮用水进行杀菌、消毒 | |
| B. | 用电解氯化铝溶液的方法制取铝单质 | |
| C. | NH4F溶液储存于玻璃试剂瓶中 | |
| D. | 加热并蒸干硫酸铜溶液可得到硫酸铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用玻璃棒蘸取NaClO溶液点在干燥的PH试纸上,试纸呈现蓝色,证明HClO是弱酸 | |
| B. | 将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液 | |
| C. | 为证明Cu与浓硫酸反应生成了CuSO4,可将反应后的混合液冷却后再加入水,若显色即可证明生成了CuSO4 | |
| D. | 用乙醇、乙酸及浓硫酸制取乙酸乙酯的过程中发现忘加碎瓷片,需在完全冷却后再补 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
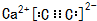 .
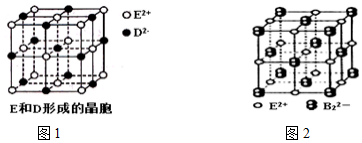
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2LNO与5.6LO2混合后,所含分子数为0.5NA. | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含OH-数为0.1NA | |
| C. | 高温下,16.8g铁与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 0.1mol NaHSO4晶体中含阳离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同素异形体 | |
| B. | H2O2分子中含有非极性键和极性共价键 | |
| C. | NH4Cl的电子式为: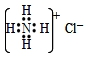 | |
| D. | CO2分子的比例模型图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com