
【题目】维生素C又称“抗坏血酸”,能将人体不易吸收的Fe3+转化为Fe2+ , 这说明维C是( )
A.电解质
B.氧化剂
C.还原剂
D.胶体
科目:高中化学 来源: 题型:
【题目】合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
(1)新鲜的瓜果蔬菜窗含_____________,多吃可以预防____________病。下列富含该成分____________的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
(2)某品牌食品调料标签的一部分如图。

①配料中的大量氨基酸态氮来源于黄豆中的蛋白质发生______反应得到。
②小麦粉中的主要营养物质是_________。
③配料中,属于着色剂的是 ;厲于甜味剂的是__________;厲于防腐剂的是___________;
④人体内有8种氨基酸必需通过食物摄入才能获取,这8种产品氨基酸成为_______氨基酸。
(3)①维生素A又称________维生素(填字母)。
A.视黄醇,水溶性 B.抗坏血酸,水溶性 C.视黄醇,脂溶性
②下列药物中属于抗生素的是___________(填字母)。
A.复方氢氧化铝片 B.阿司匹林 C.青霉素
③ 加碘盐中碘元素的存在形式是__________(填字母)
a.I2 b.KIO3 c.KI
④在食品加工或餐饮业中,特别要严加控制用量的物质是_________(填字母)。
A.亚硝酸钠 B.碳酸氢钠 C.氯化钠
⑤综合利用“地沟油”的一种方法是将它水解以获取高级脂肪酸和__________(填名称)。
⑥使用靑霉素可能会产生过敏,在用药前患者一定要进行______________。
⑦抗酸药可治疗胃酸过多的原因是这类药物中含有的一种或几种化学物质,Al(OH)3是抗酸药的一种,请写出其与胃酸反应的离子方程式________________。
⑧靑霉素属于 (选填“处方药”或“非处方药”),通常外包装盒上标有________(选填“OTC”或“R”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=11的X、Y两种碱溶液,分别从1 mL稀释至100 mL,其pH与溶液体积(V)的变化关系如图,下列说法正确的是
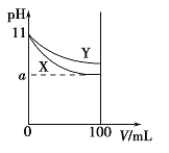
A.稀释前,X、Y中溶质碱的物质的量浓度相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.同浓度盐酸分别与X、Y这两种碱溶液恰好完全反应时,消耗盐酸的体积V(X)>V(Y)
D.若a>9,则X和Y都为弱碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将氯化钠、沙子(主要成分为SiO2)、碘三种物质组成的固体混合物分离,最科学的操作顺序是
A. 溶解、过滤、加热(升华)、蒸发(结晶)B加热(升华)、 溶解、过滤、蒸发(结晶) B. 升华、溶解、蒸馏、结晶
C. 溶解、结晶、过滤、升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第________周期第________族。
(2)E元素形成的氧化物对应的水化物的化学式为________________________。
(3)元素C、D、E形成的简单离子半径大小关系是______>________>________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:____________________。C、D还可形成化合物D2C2,D2C2中含有的化学键是_________________________。
(5)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(6)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液
B. 某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
C. 用过滤法无法除去Fe(OH)3胶体中的FeCl3
D. 向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A. 胆矾、石膏、漂白粉都是纯净物
B. 氢氧化钙、盐酸、硫酸铜均为强电解质
C. 氯化钙、烧碱、聚苯乙烯均为化合物
D. 稀豆浆、鸡蛋清溶液、雾均为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.为减少碳排放,科学家提出利用CO2和H2反应合成甲醇,其反应原理为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)上述反应常用CuO和ZnO的混合物作催化剂。经研究发现,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率有明显影响。实验数据如表所示:

根据数据表判断,催化剂中CuO的最佳质量分数为________。
(2)已知:①CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
②CO(g)+2H2(g)===CH3OH(g) ΔH2=-91 kJ·mol-1。
写出由CO2和H2制备甲醇蒸气并产生水蒸气的热化学方程式:______________________________。
(3)甲醇是清洁能源。某甲醇燃料电池的电解质为稀硫酸,其能量密度为5.93 kW·h·kg-1。该电池的负极反应式为______________。若甲醇的燃烧热为ΔH=-726.5 kJ·mol-1,该电池的能量利用率为________(结果精确到小数点后1位数字)。(已知1 kW·h=3.6×106 J)
Ⅱ.利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
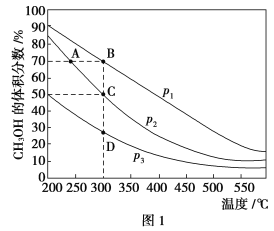
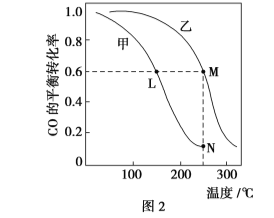
(1)该反应的ΔH________(填“>”、“<”或“=”,后同)0,p1________p2。
(2)达到平衡时,反应速率:A点________B点。平衡常数:C点________D点。
(3)在C点时,CO的转化率为________。
(4)L、M两点容器内压强:p(M)________2p(L)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com