

分析 (1)实验室通常用二氧化锰与浓盐酸共热的方法制备氯气;
(2)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故还有HCl生成;
(3)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,代入平衡常数表达式K=$\frac{c(CO)×c(C{l}_{2})}{c(COC{l}_{2})}$计算;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动,4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,结合温度对平衡影响判断;
③由图可知,10min瞬间Cl2浓度不变,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气与水制取氯气,反应方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成,故反应方程式为CHCl3+H2O2=HCl+H2O+COCl2,
故答案为:CHCl3+H2O2=HCl+H2O+COCl2;
(3)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=$\frac{c(CO)×c(C{l}_{2})}{c(COC{l}_{2})}$=$\frac{0.085×0.11}{0.04}$=0.234mol/L,故答案为:0.234mol/L;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:$\frac{0.06×0.12}{c(COC{l}_{2})}$=0.234mol/L,解得c(COCl2)=0.031mol/L;
故答案为:0.031;
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),
故答案为:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
点评 本题考查化学平衡计算、化学平衡移动、平衡常数、浓度随时间变化曲线等,(3)中理解图象中曲线变化趋势及曲线变化可能改变的条件是解本题关键,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
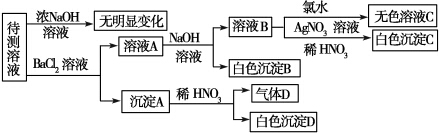
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | ||
| 化学式或 离子符号 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
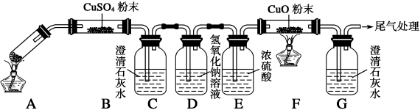
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
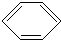 +Cl2
+Cl2
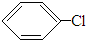 +HCl,反应类型取代反应.
+HCl,反应类型取代反应.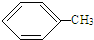 +3HO-NO2
+3HO-NO2
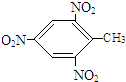 +3H2O,反应类型取代反应.
+3H2O,反应类型取代反应. +3H2
+3H2
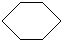 ,反应类型加成反应.
,反应类型加成反应. +Br2
+Br2
 +HBr,反应类型取代.
+HBr,反应类型取代.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
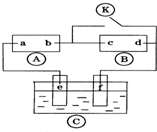 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com