

分析 (1)根据反应的化学方程式可知,该反应为吸热反应,欲使该反应发生并维持该反应进行的条件是加热;
(2)根据氧化还原反应中氧化剂和还原剂得失电子守恒结合质量守恒定律配平反应的化学方程式;
(3)NH4HCO3在高温下易分解;
(4)NH4+、Fe2+易与OH-反应,SO42-与Ba2+反应生成沉淀而减少;
(5)反应Ⅳ中两种盐溶液分别含有NH4+和Fe2+离子都易水解,加入硫酸可以抑制其水解;
解答 解:(1)根据反应的化学方程式可知,该反应为吸热反应,根据影响化学反应的因素可知,欲使该反应发生并维持该反应进行的条件是加热,
故选C;
(2)根据氧化剂与还原剂得失电子数目相等,则有Na2S~2SO2,结合元素质量守恒,可写出化学方程式为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,
故答案为:2;1;4;3;1;
(3)NH4HCO3在高温下易分解,反应Ⅲ温度需控制在35~40℃的较低温度,以提高NH4HCO3利用率和NaHCO3产率,
故答案为:防止NH4HCO3分解,提高NH4HCO3利用率和NaHCO3产率;
(4)NH4+、Fe2+易与OH-反应,SO42-与Ba2+反应生成沉淀而减少,则应加入Ba(OH)2,
故答案为:Ba(OH)2;
(5)反应Ⅳ中两种盐溶液分别含有NH4+和Fe2+离子都易水解,加入硫酸可以抑制其水解,水解的离子方程式为Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O++H+,
故答案为:Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O++H+.
点评 本题考查较为综合,设计氧化还原反应、离子反应等问题,侧重于对学生分析问题和解决问题的能力的考查,题目难度中等,注意氧化还原反应的配平.


科目:高中化学 来源: 题型:选择题
| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B和C可能都是液体酶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.2NA | |
| B. | 标准状况下 11.2 L NO与11.2L O2混合,充分反应后所含分子数为0.75NA | |
| C. | 标准状况下,22.4 LCO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
| ① | 300 | 2.00 | 2.80 |
| ② | 400 | 2.00 | 3.00 |
| ③ | 400 | 4.00 | a |
| A. | 上述反应中,△H<0 | |
| B. | 实验②中,该反应的平衡常数K=0.5 | |
| C. | 实验①经4 min达到平衡,0~4 min内υ(X)=0.2mol•L-1•min-1 | |
| D. | 实验③中a=6.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
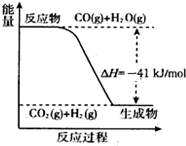 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 |
| K | 2.6 | 1.7 | 1.0 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com