


科目:高中化学 来源: 题型:
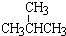 和
和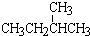 ; ②
; ② 和
和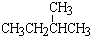 ;
;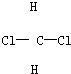 和
和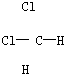
| 类别 | 同位素 | 同分异构体 | 同素异形体 | 同系物 | 同一物质 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| 体系中各物质 | CO | H2 | CH3OH |
| 物质的量浓度(mol/L) | 0.1 | 0.2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
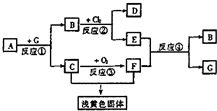 如下图为黑色固体化合物A(FeS)及其产物的一系列反应的框图,每一个方框表示有一种反应物或生成物(反应条件及反应所需和产生的水均略去),其中A、G为反应物,C、F在常温下均为气体.(已知:FeS+2H+=Fe2++H2S↑)
如下图为黑色固体化合物A(FeS)及其产物的一系列反应的框图,每一个方框表示有一种反应物或生成物(反应条件及反应所需和产生的水均略去),其中A、G为反应物,C、F在常温下均为气体.(已知:FeS+2H+=Fe2++H2S↑)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 仪器 | 药品 |
| A | 配制1mol/LNaCl溶液 | 烧杯、玻璃棒、容量瓶、胶头滴管 | 氯化钠、水 |
| B | 粗盐提纯 | 烧杯、玻璃棒、长颈漏斗、酒精灯、蒸发皿 | 粗盐、水 |
| C | 萃取碘水中的碘 | 烧杯、分液漏斗 | 碘水、乙醇 |
| D | 检验集气瓶中的气体是氧气 | 集气瓶(带玻璃片) | 带火星的木条 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com