
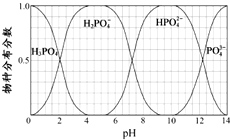
 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.

科目:高中化学 来源: 题型:
 所以“低碳经济”正成为科学家研究的主要课题.
所以“低碳经济”正成为科学家研究的主要课题.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙所需时间长 |
| B、乙所需时间短 |
| C、甲、乙同时到达 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ⅧA |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | S | Cl | Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 待测液 | 消耗标准盐酸(0.01mol?L-1)的体积 | |
| ① | 20mL NaOH溶液 | V1 mL |
| ② | 20mL NaOH溶液+10mL H2O | V2 mL |
| ③ | 敞开隔夜放置的20mL NaOH溶液 | V3 mL |
| A、c=0.01×(V1+V2+V3)/(3×20) |
| B、c=0.01×(V1+V2)/(2×20) |
| C、c=0.01×(V1+V3)/(2×20) |
| D、c=0.01×V1/20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2SO3是否被氧化(BaCl2) |
| B、FeSO4是否被氧化(KSCN) |
| C、KI是否被氧化(淀粉溶液) |
| D、漂粉精是否变质(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com