
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 放热反应的发生无需任何条件 |
分析 A、化学变化是旧键的断裂和新键的形成过程,断键成键都有能量变化;
B、干冰汽化属于物理变化;
C、反应分为吸热反应与放热反应,吸热反应反应物的总能量总是低于生成物的总能量;
D、反应吸热放热与反应条件无关,决定于反应物和生成物的能量高低.
解答 解:A、化学变化是旧键的断裂和新键的形成过程,断键吸热成键放热,故A正确;
B、干冰汽化属于物理变化,不属于吸热反应,故B错误;
C、反应分为吸热反应与放热反应,吸热反应反应物的总能量总是低于生成物的总能量,故C错误;
D、燃烧需要加热到着火点,但是放热反应,故D错误.
故选A.
点评 本题主要考查反应放热吸热的根本原因,以及有能量变化的未必是放热反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
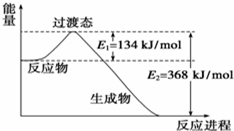 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填“大于”、“小于”或“等于”)CO2和NO的总能量.
20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填“大于”、“小于”或“等于”)CO2和NO的总能量.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
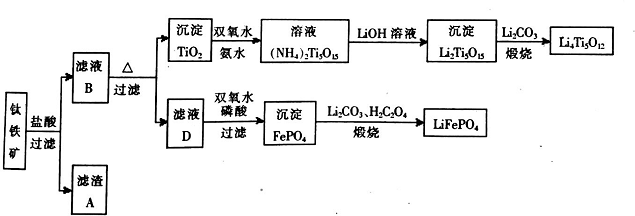
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
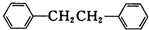 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: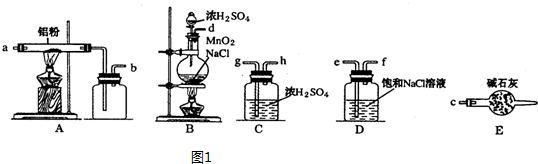
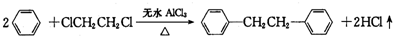
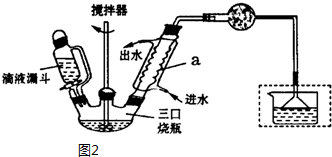
| 名称 | 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2一二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )| A. | 芥子醇分子中有两种含氧官能团 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 芥子醇与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 芥子醇能发生的反应类型有氧化、还原、取代、加成、聚合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
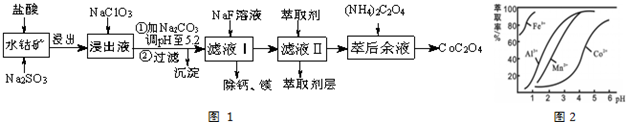
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
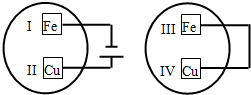 把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )
把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )| A. | II和III附近 | B. | II和IV附近 | C. | I和III附近 | D. | I和IV附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | CH3CH2CHBrCH2Br | C. | H3CHBrCHBrCH3 | D. | CH2BrCBr(CH3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com