
分析 该反应中还原剂为Cu,根据反应方程式计算出消耗铜的物质的量,再根据m=nM计算出消耗铜的质量;根据电子守恒计算出电子转移的物质的量;被还原的硝酸转化成一氧化氮,未被还原的HNO3转化成3Cu(NO3)2,结合铜的物质的量计算出其比值.
解答 解:标准状况下11.2L NO的物质的量为:n(NO)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
该反应中氧化剂为硝酸,还原剂为Cu,根据反应方程式可得关系式:3Cu~8HNO3~2NO,则生成0.5molNO时消耗Cu的物质的量为:0.5mol×$\frac{3}{2}$=0.75mol,消耗铜的质量为:64g/mol×0.75mol=48g;
根据电子守恒,生成0.5molNO转移电子的物质的量为:0.5mol×(5-2)=1.5mol;
反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中被还原的硝酸转化成NO,未被还原的HNO3转化成3Cu(NO3)2,则被还原硝酸的物质的量等于NO的物质的量,为0.5mol,未被还原的HNO3的物质的量等于硝酸铜中的硝酸根离子的物质的量,则未被还原的HNO3的物质的量为:0.75mol×2=1.5mol,
所以反应中被还原的HNO3与未被还原的HNO3的质量之比=物质的量之比=0.5mol:1.5mol=1:3,
故答案为:48;1.5;1:3.
点评 本题考查了氧化还原反应的计算,题目难度不大,明确氧化还原反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
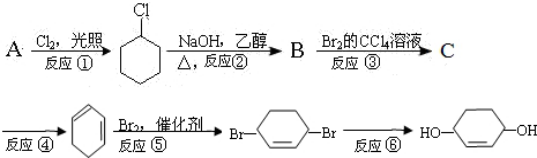
 .
.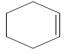 +Br2→
+Br2→ .
.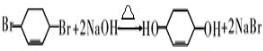 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol
一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| No | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 红细胞计数 | 2.3 | 3.5~5 | 1×10 12/L |
| 2 | 血红蛋白 | 75 | 110~150 | g/L |
| 3 | 血小板计数 | 205.5 | 100~300 | 109/L |
| A. | 钙 | B. | 铁 | C. | 锌 | D. | 钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com