
下列离子方程式与所述事实相符且正确的是 ( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O =HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气: MnO2+2H++2Cl- 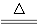 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3 =2FeO42-+3Cl-+H2O+4H+
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:选择题
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。则下列有关说法中不正确的
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。则下列有关说法中不正确的
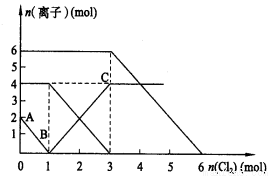
A.还原性:I- >Fe2+ > Br-
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:填空题
(10分)有某种含有少量FeCl2杂质的FeCl3样品。现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量mg样品(在2—3g范围内):
②向样品中加入10mL 6 moL·L-1的盐酸,再加入蒸馏水,配制成250mL溶液:
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全:
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重。
试回答下列问题:
(1)溶解样品时,要加入盐酸,原因是 ;
(2)加入氯水后,反应的离子方程式为 ;
(3)加入过量氨水生成沉淀的离子方程式为 ;
(4)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(5)步骤⑤中检验沉淀是否洗净的方法是 。
(6)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:选择题
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为
A.纯盐酸、空气、硫酸、干冰
B.蒸馏水、氨水、碳酸氢钠、二氧化硫
C.胆矾、盐酸、铁、碳酸钙
D.生石灰、漂白粉、氯化铜、碳酸钠
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
(14分)I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O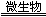 4H++2Fe2++4SO42- ; ②Fe2++O2+H+
4H++2Fe2++4SO42- ; ②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+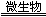 3Fe2++2S; ④2S+3O2+2H2O
3Fe2++2S; ④2S+3O2+2H2O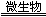 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是___________。 在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是___________。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为8CuFeS2+ 21O2  8Cu+4FeO+2Fe2O3+16SO2.若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
8Cu+4FeO+2Fe2O3+16SO2.若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | 将少量浓氨水滴入Al2(SO4)3溶液 | 将少量Al2(SO4)3溶液滴入浓氨水 |
B | 将少量SO2通入Ba(OH)2溶液 | 将过量量SO2通入Ba(OH)2溶液 |
C | 将0.1molCl2通入含有0.2molFeBr2的溶液中 | 将0.3molCl2通入含有0.2molFeBr2的溶液中 |
D | 将过量BaCl2溶液与少量Na2SO4溶液混合 | 将少量Ba(OH)2溶液与过量MgSO4溶液混合 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:实验题
(8分)为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
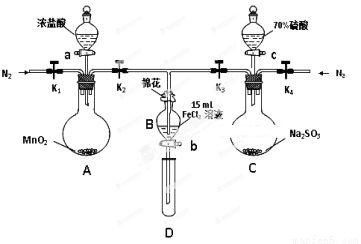
实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,关闭K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式 。
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
对于下列化学事实,表述错误的是( )
A.浓硝酸需要在棕色瓶中保存,以防止见光分解
B.向Fe(OH)3胶体中逐滴滴入过量的稀硫酸,会出现“先沉淀后溶解”的现象
C.向石蕊试液中滴加氨水,溶液变红
D.除去Na2CO3固体中少量的NaHCO3,常用加热的方法
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列关于某溶液所含离子检验的方法和结论正确的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
B.通入少量Cl2后,溶液变为黄色,再加入淀粉溶液后,溶液变蓝,说明有I-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定有CO32-或SO32-
D.往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com