


| ||


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
| A、甲的摩尔体积比乙摩尔体积小 |
| B、甲的分子数比乙的分子数多 |
| C、甲的物质的量比乙的物质的量少 |
| D、甲的相对分子质量比乙相对分子质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH+HCl=NaCl+H2O | ||||
B、2NaHCO3
| ||||
| C、Fe+CuSO4=Cu+FeSO4 | ||||
| D、NH3+HCl=NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O |
| C、氢氧化铜溶于盐酸:Cu2++2OH-+2H+=Cu2++2H2O |
| D、MgCl2溶液中滴加氨水:Mg2++2OH-=Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:


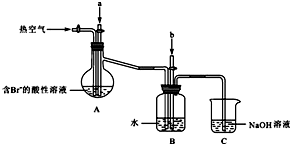
查看答案和解析>>
科目:高中化学 来源: 题型:
 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图所示,则下列判断正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图所示,则下列判断正确的是( )| A、MFe2Ox是还原剂 |
| B、SO2是该反应的催化剂 |
| C、x>y |
| D、氧化性:MFe2Oy>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com