
描述 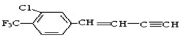 分子的下列叙述中,错误的是
分子的下列叙述中,错误的是
A.与苯环直接相连的原子都在同一平面上
B.分子中共有10个不饱和碳原子
C.最多有18个原子可能处在同一个平面上
D.分子式为C11H6ClF3
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2015-2016学年山西省高二12月月考化学试卷(解析版) 题型:选择题
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO32-+I2+H2O”设计成原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是
AsO32-+I2+H2O”设计成原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是
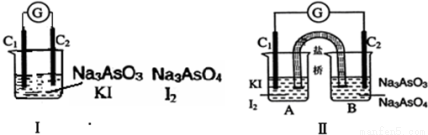
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变浅
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2+2e-═2I-
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期12月阶段测化学试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色,在潮湿的空气中能发生下列反应:3NF3+5H20=2NO+HNO3+9HF。下列说法正确的是
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的氮原子的物质的量之比为2:l
C.若反应生成0.2 mol HNO3,则反应中共转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象
查看答案和解析>>
科目:高中化学 来源:2015-2016年湖南湘潭、岳阳两校高二上第三次联考化学卷(解析版) 题型:填空题
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
则ΔH1﹤ΔH2
②H2(g)+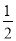 O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。
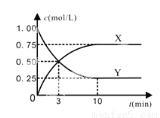
回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
A.容器内各气体的体积分数保持不变
B.混合气体密度不变
C.3v逆(CH3OH) =v正(H2)
D.混合气体的平均相对分子质量不变
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
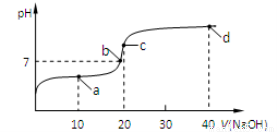
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016年湖南湘潭、岳阳两校高二上第三次联考化学卷(解析版) 题型:实验题
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液;
B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为 c mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写) → → → D → 。
(2)操作D中液面应调整到___________________________________。
(3)滴定至终点的现象是______________________________________。
(4)该烧碱样品的纯度计算式是________________________________。
(5)下列各操作(其他操作均正确)中,将导致测定结果偏高的是______________(填写序号)。
①操作B中的碱式滴定管只用蒸馏水洗未用所盛烧碱溶液润洗
②酸式滴定管用蒸馏水洗涤后,直接装入标准H2SO4溶液
③滴定时,锥形瓶摇动太剧烈,有少量液体溅出
④滴定到终点时,滴定管尖嘴部分悬有液滴
⑤酸式滴定管读数时滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源:2015-2016年湖南湘潭、岳阳两校高二上第三次联考化学卷(解析版) 题型:选择题
下列有关平衡常数的说法正确的是
A. 温度越高,K值越大 B. K值越大,正反应速率越大
C. K值的大小与起始浓度有关 D. K值越大,反应物的转化率越大
查看答案和解析>>
科目:高中化学 来源:2015-2016年江西省高二上12月月考化学试卷(解析版) 题型:填空题
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含离子的化学组分及其浓度如下表:
离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料。
已知:2H2(g)+O2(g)=2H2O(g) K1 2C(s)+O2(g)=2CO(g) K2
2C(s)+2H2O(g)=2CO(g)+2H2(g) K 则K=_____________(用含K1、K2的式子表示)。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:
N2 (g)+O2(g) 2NO(g) △H
2NO(g) △H 0
0
目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016年江西省高二上12月月考化学试卷(解析版) 题型:填空题
有一种pH为12的NaOH溶液100 mL,要使它的pH降到11,
(1)如果加入蒸馏水,应加 mL;(提示:溶液总体积具有加和性。下同)
(2)如果加入pH=l0的NaOH溶液,应加_______ mL;
(3)如果加入0.01 mol·L-1的盐酸,应加_______ mL。
查看答案和解析>>
科目:高中化学 来源:2015-2016年山西省高一上12月月考化学试卷(解析版) 题型:选择题
下列方法制取O2:①KClO3(MnO2)受热分解;②KMnO4受热分解;③H2O2中加MnO2,若制得相同质量的O2,反应中上述各种物质(依编号顺序)的电子转移数目之比是
A.2:1:2: B.1:1:1 C.2:2:1 D.1:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com