
 酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经 氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
氢气还原所得红色产物中是否含有碱性氧化物Cu2O。 由题给信息可知,Cu2O是碱性氧化物,可溶于酸溶液:Cu2O+2H+=2Cu++H2O;而Cu+在酸溶液中不稳定,自身歧化成Cu2+和Cu。2Cu+=Cu2++Cu。题给试剂中,浓硫酸、浓硝酸、稀硝酸、FeCl3稀溶液均显酸性,且都能与Cu反应生成Cu2+,如果选用这些试剂,它们和样品反应后的溶液都呈蓝色(Cu2+),但分不清是与Cu还是与Cu2O反应产生的Cu2+,故无法确证样品中是否含有Cu2O。根据以上分析,选用的试剂必须符合两个条件,一是呈酸性,二是不能与Cu反应。在题给试剂中只有稀硫酸符合。
由题给信息可知,Cu2O是碱性氧化物,可溶于酸溶液:Cu2O+2H+=2Cu++H2O;而Cu+在酸溶液中不稳定,自身歧化成Cu2+和Cu。2Cu+=Cu2++Cu。题给试剂中,浓硫酸、浓硝酸、稀硝酸、FeCl3稀溶液均显酸性,且都能与Cu反应生成Cu2+,如果选用这些试剂,它们和样品反应后的溶液都呈蓝色(Cu2+),但分不清是与Cu还是与Cu2O反应产生的Cu2+,故无法确证样品中是否含有Cu2O。根据以上分析,选用的试剂必须符合两个条件,一是呈酸性,二是不能与Cu反应。在题给试剂中只有稀硫酸符合。

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeO | B.Fe2O3 | C.CaO | D.Cu2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




 (1)炼铁高炉分为五部分,铁矿石与高温煤气主要在 部分发生反应,在 部分开始生成铁和炉渣。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在 部分发生反应,在 部分开始生成铁和炉渣。 (2)炼钢时,除磷的化学方程式为 ;
(2)炼钢时,除磷的化学方程式为 ; 加入硅、锰和铝的目的是 。
加入硅、锰和铝的目的是 。 (3)不锈钢含有的Cr元素是在炼钢过程的氧吹 (填“前”或“后”)加入,原因是 。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹 (填“前”或“后”)加入,原因是 。 (4)炼铁和炼钢生产中,尾气均含有的主要污染物是 。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是 。 从环保和经济角度考虑,上述尾气经处理可用作 。
从环保和经济角度考虑,上述尾气经处理可用作 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3 | B.反应后所得溶液中的Fe2+和Cl–的物质的量之比为1:3 | C.混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 | D.混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
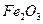 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)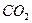 气体
气体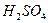 。溶液中,充分反应后,测得的实验数据如下表所示:
。溶液中,充分反应后,测得的实验数据如下表所示:| 实验序号 | I | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用稀盐酸洗去残留在试管壁上的铜 |
| B.用碱石灰吸收氨气中的水蒸气 |
| C.用稀盐酸清洗做焰色反应的铂丝 |
| D.用CCl4萃取碘水中的碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com