
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.8 |
分析 (1)根据碳酸氢钠样品消耗的氢离子物质的量相等,计算出消耗硫酸的体积;
(2)先求出通入二氧化碳消耗的碳酸钠的质量,然后根据反应计算出生成的碳酸氢钠的质量,再计算析出的碳酸氢钠的质量;
(3)根据碳酸氢钠减少的质量,计算出生成的碳酸钠的质量,再用814.8kg减掉现有的碳酸钠质量,就是需要添加的碳酸钠质量;
(4)先根据二氧化碳的体积计算出生成的碳酸氢钠和反应的碳酸钠质量,反应后溶液中含碳酸氢钠504kg,减掉生成的碳酸氢钠,得到原晶体中的碳酸氢钠质量,最后计算出水的质量,就可以求出晶体的化学式.
解答 解:(1)样品消耗盐酸中的氢离子的物质的量是:n(H+)=0.1000mol/L×0.020L=0.002mol,需要0.05618mol/L的硫酸的体积为:$\frac{0.002mol}{2×0.05618mol•L{\;}^{-1}}$≈17.80mL,
故答案是:17.80;
(2)设生成的碳酸氢钠质量为m,向溶液中通入二氧化碳,发生了反应:Na2CO3+CO2+H2O=2NaHCO3,反应消耗的碳酸钠的质量是:814.8kg-137.7kg=677.1kg
Na2CO3+CO2+H2O=2NaHCO3
106 168
677.1kg m
m=$\frac{677.1kg×168}{106}$≈1073.1kg
则析出的碳酸氢钠晶体的质量:1073.1+400.3-428.8=1044.6 kg
答:析出的碳酸氢纳晶体的质量是1044.6kg;
(3)解:设碳酸氢钠分解生成了xkg碳酸钠,碳酸氢钠分解反应为:2NaHCO3=Na2CO3+CO2+H2O,被分解的碳酸氢钠质量是:428.8kg-400.3kg=28.5kg,
2NaHCO3=Na2CO3+CO2+H2O
168 106
28.5kg x
x=$\frac{28.5kg×106}{168}$=17.98 kg,
则补加的碳酸钠质量814.8-137.7-17.98=659.1 kg,
答:需要补加的碳酸钠的质量是:659.1 kg;
(4)设晶体中含有碳酸钠mkg,通入二氧化碳生成了m1kg碳酸氢钠,
Na2CO3 +CO2 +H2O=2NaHCO3
106 22.4×103 168
m 44.8×103 m1
m=$\frac{106×44.8×10{\;}^{3}}{22.4×10{\;}^{3}}$=212kg,m1=$\frac{168×44.8×10{\;}^{3}}{22.4×10{\;}^{3}}$=336kg,
则452kg晶体中含Na2CO3 212 kg,NaHCO3:504kg-336kg=168kg,水:452kg-212kg-168kg=72 kg,
所以n(Na2CO3):n(NaHCO3):n(H2O )=$\frac{212}{106}$:$\frac{168}{84}$:$\frac{72}{18}$=1:1:2
该晶体的化学式为NaHCO3•Na2CO3•2H2O,
答:该晶体的化学式为NaHCO3•Na2CO3•2H2O.
点评 本题考查了测定碳酸钠、碳酸氢钠的含量测定,本题计算量比较大,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 10ml | B. | 30ml | C. | 50ml | D. | 70ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| c(SO2)/mol•L-1 | 0.04 | 0.024 | 0.012 | 0.006 | 0.004 | 0.002 | 0.002 |
| c(O2)/mol•L-1 | 0.04 | 0.032 | 0.026 | 0.023 | 0.022 | 0.021 | 0.021 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
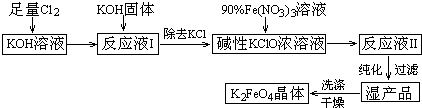
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com