
| A. | HClO HCl Mg(OH)2 MgCl2 | |
| B. | CO2 H2CO3 CaCO3 Ca(HCO3)2 | |
| C. | H2O HNO3 NH3•H2O NH4NO3 | |
| D. | SO3 NaHSO4 NaOH Na2SO4 |
分析 氧化物是由两种元素组成并且一种元素是氧元素的化合物.
电离时生成的阳离子都是氢离子的化合物是酸;
电离时生成的阴离子都是氢氧根离子的化合物是碱;
由金属离子和酸根离子组成的化合物是盐.
解答 解:A、次氯酸和氯化氢属于酸,氢氧化镁属于碱,氯化镁属于盐.故A错误;
B、二氧化碳属于氧化物,碳酸属于酸,碳酸钙、碳酸氢钙属于盐.故B错误;
C、水属于氧化物,硝酸属于酸,一水合氨属于碱,硝酸铵属于盐.故C正确;
D、三氧化硫属于氧化物,硫酸氢钠、硫酸钠属于盐,氢氧化钠属于碱.故D错误;
故选C.
点评 本题主要考查物质的分类,解答时要从氧化物,酸碱盐的概念方面进行分析、判断,从而得出正确的结论,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
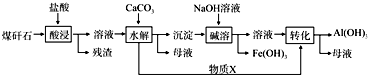
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 道尔顿、汤姆生、卢瑟福和门捷列夫等对原子结构模型的建立均作出了卓越的贡献 | |
| C. | 化学反应能制造出新的物质,也能制造出新的元素,并伴有能量变化 | |
| D. | 感染MERS致死率较高,为防止感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为17 | B. | 质量数为15 | ||
| C. | 中子数与质子数之差为17 | D. | 质子数为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下:
A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙醇和钠反应,键①断裂 | B. | 铜催化下和O2反应,键①③断裂 | ||
| C. | 乙醇与乙酸反应,键①断裂 | D. | 铜催化和O2反应,键①②断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 浓硫酸具有强氧化性,可用于与亚硫酸钠反应制取二氧化硫 | |
| C. | 氢氧化铝能表现弱酸性,可用于制抗酸药品 | |
| D. | 铜的金属活动性比铁的弱,可在海轮外壳上装若干铜块以减缓船体腐蚀速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com