
某浓度的铬酸溶液(H2CrO4),向其中加入少量碱以调节pH值(忽略溶液体积变化),下表为各离子浓度(mol/L)与pH之间的关系如下表,下列说法不正确的是( )
| pH | [H2CrO4] | [HCrO4﹣] | [CrO42﹣] | [Cr2O72﹣] |
| 4 | 0 | 0.095 | 0.035 | 0.435 |
| 7 | 0 | 0.086 | 0.274 | 0.320 |
| 10 | 0 | 0.004 | 0.990 | 0.003 |
|
| A. | 铬酸的电离方程式为H2CrO4═2H++CrO42﹣ |
|
| B. | 铬酸的总浓度为1mol/L |
|
| C. | [H+]越大,HCrO4﹣浓度越大 |
|
| D. | 已知Cr2O72﹣为橙色离子,CrO42﹣为黄色离子,随着pH的升高溶液将逐渐变为黄色 |
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
A.根据不同pH[HCrO4﹣]、[H2CrO4]知,H2CrO4第一步完全电离,第二步部分电离;
B.c(H2CrO4)=c(CrO42﹣)mol/L+c(HCrO4﹣)mol/L+2c(Cr2O72﹣)mol/L;
C.根据溶液pH与HCrO4﹣的关系判断;
D.根据表中数据知,pH越大,[CrO42﹣]越大、[Cr2O72﹣]越小.
解答:
解:A.根据不同pH[HCrO4﹣]、[H2CrO4]知,H2CrO4第一步完全电离,第二步部分电离,所以其第一步电离方程式为H2CrO4═H++HCrO4﹣,故A错误;
B.c(H2CrO4)=c(CrO42﹣)mol/L+c(HCrO4﹣)mol/L+2c(Cr2O72﹣)mol/L,在pH=4时,c(CrO42﹣)=0.035mol/L,c(HCrO4﹣)=0.095mol/L,c(Cr2O72﹣)=0.435 mol/L,所以铬酸溶液的物质的量浓度约为1.00mol/L,故B正确;
C.根据表中数据知,溶液pH越小,则氢离子浓度越大,HCrO4﹣的浓度越大,故C正确;
D.根据表中数据知,pH越大,[CrO42﹣]越大、[Cr2O72﹣]越小,则随着pH的升高溶液将逐渐变为黄色,故D正确;
故选A.
点评:
本题考查了弱电解质的电离,明确表中数据的含义是解本题关键,根据表中pH、各种离子浓度之间的关系即可解答,注意结合原子守恒分析,题目难度不大.


科目:高中化学 来源: 题型:
现有下列四组 物质
物质
A、CaO、MgO、CO2、CuO B、H2、Cl2、N2、Cu
C、O2、 Fe、Cu、 Zn D、HCl、H2O、H2SO4、HNO3
(1)请填写下表:
| A组 | B组 | C组 | D组 | |
| 分类标准 | 金属氧化物 | 金属单质 | ||
| 不属于该类别的物质 | Cu | H2O |
(2)已知(1)中涉及到的不属于该类别的四种物质间相互作用可生成一种新物质——碱式碳酸铜[化学式:Cu2(OH)2CO3]。
①生成碱式碳酸铜的化学方程式是__________________________________,此反应______(填“是”或“不是”)氧化—还原反应。
②碱式碳酸铜与D组中的类别物质反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子为非极性分子 |
| C | 金刚石的熔点低于石墨 | 石墨熔融时除了破坏共价键,还需破坏范德华力 |
| D | HF的沸点高于HCl | H﹣F的键能大于H﹣Cl |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中可以说明2HI(g)⇌H2(g)+I2(g)已达到平衡的是( )
|
| A. | c(HI):c(H2):c(I2)=2:1:1时 |
|
| B. | 温度和体积一定时,混合气体的颜色不再改变 |
|
| C. | 单位时间内生成n mol H2的同时消耗2n mol HI |
|
| D. | 温度和体积一定时,容器内压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
mA(s)+nB(g)⇌qC(g),的可逆反应,在1×105pa与2×105pa两种压力条件下,B的体积分数与温度的关系如右图所示,有关叙述正确的是( )
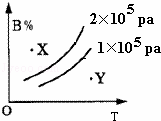
|
| A. | △H>0 | B. | X点,v正>v逆;Y点,v正<v逆 |
|
| C. | m+n>q | D. | X点比Y点反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
某同学进行实验,实验装置如右图.其中A、B的成分见下表
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是 .
(2)实验开始前需要检查气密性,其操作是 分液漏斗中A溶液应该 一次性 加入(填“一次性”或“逐滴滴加”).
(3)完成该实验还需要 (填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是 .
(4)请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图.

乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率.
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(5)X= ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 .
(6)2号反应中,H2C2O4的反应速率为 .

查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有如图1转化关系:(部分反应物、产物及反应条件已略去).
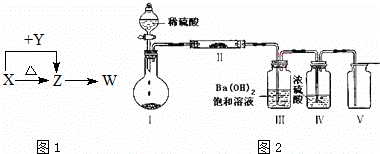
请回答下列问题:
(1)X与Y在水溶液中反应的离子方程式为 ;
(2)W的结构式为
(3)将Z装入圆底烧瓶,利用如图2装置(夹持固定装置已略去)进行实验,装置Ⅱ中的物质由短周期元素组成,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种能使带火星木条复燃的气体.装置Ⅱ中物质的化学键类型为 ;
(4)下列关于X、Z的鉴别方法不正确的是
A.分别加热X、Z的粉末,将产生的气体通入澄清石灰水,观察现象
B.分别将X、Z配成稀溶液,逐滴滴加稀盐酸,观察现象
C.分别将X、Z配成稀溶液,分别加入氯化钙溶液,观察现象
D.分别将X、Z配成稀溶液,分别加入澄清石灰水,观察现象.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com