
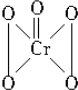
| A. | 全部-1价 | B. | $\frac{4}{5}$为-1价,$\frac{1}{5}$为-2价 | ||
| C. | 全部-2价 | D. | $\frac{4}{5}$为-2价,$\frac{1}{5}$为-1价 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).
已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该物质属于盐类 | |
| B. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3mol H+ | |
| D. | 该药剂不适合于胃溃疡患者服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
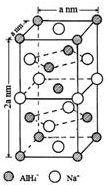 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.  .
.  .
.  (标明配位键).
(标明配位键). 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要完成实验需称取10.6gNa2CO3•10H2O晶体 | |
| B. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线,会导致溶液浓度偏高 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | Na2SO4溶液中:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合所得溶液中:c (CH3COOH)+c(CH3COO-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英与烧碱溶液共热:SiO2+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$SiO32-+H2O | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++4OH-=[Al(OH)4]- | |
| C. | 在氢氧化钠溶液中通入过量的CO2:2OH-+CO2=CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液反应H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com