
| A. | 盐酸滴入氨水中:H++OH-═H2O | |
| B. | 碳酸氢铵溶液与足量氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 氢氧化钠溶液中通入过量二氧化硫:SO2+OH-═HSO3- | |
| D. | 碳酸钙溶解于稀硝酸中:CO32-+2H+═CO2↑+H2O |
分析 A.一水合氨为弱碱,应保留化学式;
B.漏掉铵根离子与氢氧根离子的反应;
C.二氧化硫过量,反应生成亚硫酸氢钠;
D.碳酸钙为沉淀,应保留化学式;
解答 解:A.盐酸滴入氨水中,离子方程式:H++NH3•H2O=NH4++H2O,故A错误;
B.碳酸氢铵溶液与足量氢氧化钠溶液混合,离子方程式:NH4++HCO3-+2OH-═CO32-+H2O+NH3•H2O,故B错误;
C.氢氧化钠溶液中通入过量二氧化硫,离子方程式:SO2+OH-═HSO3-,故C正确;
D.碳酸钙溶解于稀硝酸中,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故D错误;
故选:C.
点评 本题考查了离子方程式,明确反应实质是解题关键,注意化学式的拆分,注意反应物用量对反应产物的影响,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 茂密树林中的道道光柱,既谁一种自然现象又是光学现象,与胶体知识无关 | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 | |
| D. | CO2合成聚碳酸酯可降解塑料,以实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 化学键的常见类型为离子键、共价键和氢键 | |
| D. | 离子化合物中一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或 最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素④气态氢化物的稳定性小于元素⑤气态氢化物的稳定性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素④⑥形成的化合物具有两性 | |
| D. | 元素④⑥⑧的最高价氧化物的水化物两两之间皆能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中c(OH-)减小 | B. | pH的变化值小于2 | ||
| C. | 溶液中H+的数目增大 | D. | Kw的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
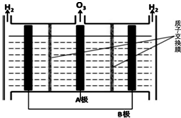 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com