
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,逆反应速率减小 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O |
分析 化学平衡常数,是指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应.
A、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,升高温度平衡向吸热反应移动;
B、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大;
C、该反应前后气体的体积不发生变化,恒温恒容时,加入不反应的气体,增大压强,平衡不移动,H2的浓度不变;增大氢气的浓度,增大压强,平衡向正反应移动,平衡是氢气的浓度增大,与增大压强的方法有关;
D、反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g).
解答 解:A、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应,即反应的焓变为正值,故A错误;
B、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大,故B错误;
C、恒温恒容时,增大氢气的浓度,增大压强,平衡向正反应移动,平衡时氢气的浓度增大,故C错误;
D、反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),故D正确.
故选D.
点评 本题考查外界条件对化学平衡的影响、化学平衡常数等,难度中等,注意对化学平衡常数的理解,同一反应,化学计量数不同,平衡常数不同.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).
.该化合物的类型是离子化合物(“离子化合物”或“共价化合物”). (填结构式).
(填结构式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把没用完的药品倒回原试剂瓶中保存 | |
| B. | 配制稀硫酸时,先在量筒内放好水,再缓缓地加入一定量的浓硫酸 | |
| C. | 用天平称量药品质量时,先加质量大的砝码,再加质量小的砝码 | |
| D. | 用排水取气法收集气体时,导管应插入试管底部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种饮料不含任何化学物质 | |
| B. | 长期饮用纯水,对身体有益 | |
| C. | 这种“神奇液体”加入水中,可以“以水代油”作为发动机的燃料 | |
| D. | 没有水就没有生命 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第四周期 | B. | 第二周期 | C. | 第ⅣA主族 | D. | 第ⅤA主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
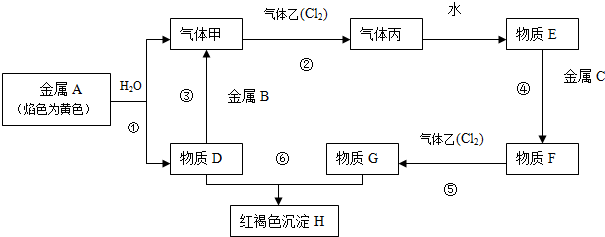
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com