
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 单质钠具有很强的还原性,钠离子具有很弱的氧化性 | |
| C. | Na着火时不能用水灭火,可用细沙覆盖灭火 | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
分析 A、钠在通常条件下反应生成氧化钠;
B、金属单质的还原性越强,其阳离子的氧化性越弱;
C、钠和水、二氧化碳反应;
D、钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀.
解答 解:A、钠在通常条件下反应生成氧化钠,点燃条件生成过氧化钠,故A错误;
B、4.6 g Na与O2完全反应,生成7 g产物时,反应的氧气为2.4g,依据化学方程式计算分析判断钠全部反应是电子0.2mol,故B正确;
C、钠原子的还原性很强,钠离子的氧化性很弱,故C正确;
D、钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,将少量Na投入到CuS04溶液中,既有沉淀生成又有气体放出,故D正确;
故选A.
点评 本题考查物质性质的分析应用,反应条件和产物的判断,金属钠性质的分析应用是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中再加水稀释 |
| C | 确定Na2SO3样品是否部分被氧化 | 取样于试管中,加入稀硝酸酸化,再滴加BaCl2溶液,观察是否有白色沉淀生成 |
| D | 检验乙醇发生消去反应生成 乙烯 | 将生成的气体直接通入盛有酸性高锰酸钾溶液的试剂瓶,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
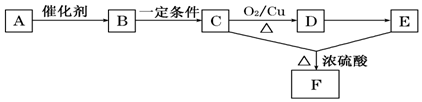
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?H2O+CO2↑ | B. | KOH═K++O2-+H+ | ||
| C. | HClO═H++ClO- | D. | Na2CO3═2Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 适量的HCl | B. | 适量的NaCl | C. | 适量的氨水 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 使酚酞变红色的溶液中:Na+、Na+、SO32-、NO3- | |
| C. | 能与金属铝反应生成氢气的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 无色透明的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
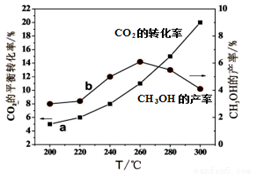 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60% | 40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com