
【题目】下列叙述正确的是
A.将0. 5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) ΔH=-38.6kJmol-1
2 NH3(g) ΔH=-38.6kJmol-1
B.C(石墨)=C(金刚石)ΔH=+1.9kJmol-1,说明金刚石比石墨稳定
C.甲烷的燃烧热△H=-890. 3 kJmol-1,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890. 3 kJmol-1
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.4 kJmol-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ
【答案】D
【解析】
A.将0. 5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,因该反应为可逆反应,因此将1mol N2和3molH2置于密闭容器中充分反应生成NH3(g),放出的热量不是38.6kJ,A项错误;
B.石墨转化为金刚石为吸收热量的反应,那么石墨所具有的能量低于金刚石所具有的能量,能量越低,物质越稳定,因此石墨比金刚石稳定,B项错误;
C.甲烷的燃烧热△H=-890. 3 kJmol-1,因此甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890. 3 kJmol-1,C项错误;
D.氢氧化钠固体溶解的过程要放出热量,20g氢氧化钠固体的物质的量为0.5mol,溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10。在该温度下,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计)。下列说法正确的是()
A.AgCl的溶解性为难溶,则该物质不溶于水
B.沉淀生成后,溶液中Ag+的浓度1×10-5mol/L
C.沉淀生成后,溶液中NO3-的浓度1.8×10-2mol/L
D.沉淀生成后,溶液的pH为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法原理是:NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl析出碳酸氢钠,下列实验装置及原理设计说法不合理的是:

A.用装置甲制取氨气时得到氨气很少,主要原因是分解得到NH3、HCl的遇冷会重新化合
B.用装置乙生成的CO2速率很慢,原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面
C.用装置丙模拟侯氏制碱法,可以同时通入NH3、CO2,也可以先通氨气再通CO2
D.用装置丁分离得到产品NaHCO3,为得到干燥产品,也可采用减压过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙酰氨基苯酚X是常用的非甾类消炎解热镇痛药。可用如下路线来合成:
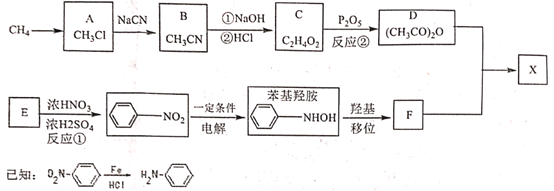
请回答下列问题:
(1)下列说法正确的是:_____________
A 反应①②皆为取代反应 B 有机物D能与水反应生成C
C F既能与强酸反应又能与强碱反应 D X分子中含有酚羟基和肽键两种官能团
(2)X与足量氢氧化钠反应的化学方程式:_____________。
(3)分析F分子结构特点和X合成原理后,认为制得X中有某种副产物,请写出该副产物的结构简式:___
(4)写出同时满足下列条件的X的所有同分异构体的结构简式:__________
①分子中含有-NH2;
②与氯化铁溶液发生显色反应;
③苯环上的取代基不超过3个且苯环上只有两种不同环境的H
(5)请设计以甲苯为原料合成![]() 的路线(用流程图表示,无机物任选)__________
的路线(用流程图表示,无机物任选)__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭体系中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
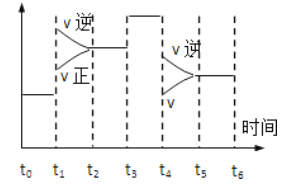
(1)处于平衡状态的时间段是__.
(2)t1、t3、t4时刻体系中分别改变的是什么条件?
t1:__,t3:__,t4:__.
(3)下列各时间段时,氨的体积分数最高的是______。
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是
A.CH4和C2H4B.C2H2和C2H4C.C2H4和C2H6D.C3H4和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2HI(g) ![]() H2(g) + I2(g) - 11 kJ,正确的是
H2(g) + I2(g) - 11 kJ,正确的是
A.反应物的总键能低于生成物的总键能
B.1mol I2(g)中通入1mol H2(g),反应放热11kJ
C.等物质的量时,I2(g)具有的能量低于I2(l)
D.平衡时分离出HI(g),正反应速率先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或化学用语的表述正确的是
A. 由水电离出的c(H+)=1.0×10-12 molL1的溶液中可能大量存在:Na+、K+、SO32-、HCO3-
B. 常温下,c(OH-)/c(H+)=1.0×1012的溶液中可能大量存在NH4+、Na+、Cl-、NO3-
C. 硫酸氢钠溶于水的电离方程式为:NaHSO4=Na++H++SO42-
D. 碳酸钠溶液呈碱性的原因:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com