
【题目】Ⅰ、研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%。写出CO2溶于水产生HCO3-的方程式:___、___。
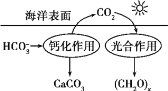
(2)在海洋碳循环中,通过如图所示的途径固碳。写出钙化作用的离子方程式:___。
Ⅱ、为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:

请回答:(1)X的化学式是____。
(2)绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___。
(3)加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式___。
【答案】CO2+H2OH2CO3 H2CO3H++HCO3- 2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O Cu2(OH)3Cl CuCl2+H2O![]() CuO+2HCl 4HCl+O2
CuO+2HCl 4HCl+O2![]() 2H2O+2Cl2
2H2O+2Cl2
【解析】
Ⅰ(1)二氧化碳溶于水生成的碳酸为弱酸,部分电离生成碳酸氢根;
(2)通过固碳途径图可知,钙化作用是将碳酸氢根转化为碳酸钙,同时释放出二氧化碳,依据元素守恒以及电荷守恒得出钙化作用的离子方程式为;
II(1)混合气体A经无水CaCl2吸收水蒸气,根据水蒸气的质量计算其物质的量,气体B通入稀硝酸酸化的硝酸银溶液产生白色沉淀,白色沉淀应为AgCl,气体B为氯化氢,根据氯元素守恒计算氯化氢物质的量,混合气体A为水蒸气和HCl的混合气体;由绿色溶液C与氢氧化钠溶液反应生成蓝色沉淀知,蓝色沉淀为氢氧化铜,C中一定有铜离子,黑色固体M为CuO,CuO与气体B的浓溶液即浓盐酸反应生成氯化铜溶液,C为氯化铜溶液,再计算CuO的物质的量,根据元素守恒计算出21.45g X中n(Cu):n(O):n(H):n(Cl)的比值,从而确定X的化学式;
(2)绿色溶液C为CuCl2溶液,蒸干后生成氢氧化铜和氯化氢,进一步灼烧得到固体M为CuO,先写出每一步的反应方程式,再进行加合得到总反应的化学方程式;
(3)气体B为HCl,与氧气发生置换反应,则产物为氯气和水,根据得失电子守恒和元素守恒配平该反应的化学方程式。
Ⅰ(1)二氧化碳溶于水生成的碳酸为弱酸,部分电离生成碳酸氢根,有关方程式为:CO2+H2OH2CO3,H2CO3H++HCO3;
故答案为:CO2+H2OH2CO3;H2CO3H++HCO3;
(2)通过固碳途径图可知,钙化作用是将碳酸氢根转化为碳酸钙,同时释放出二氧化碳,依据元素守恒以及电荷守恒得出钙化作用的离子方程式为:2HCO3+Ca2+=CaCO3↓+CO2↑+H2O;
故答案为:2HCO3+Ca2+=CaCO3↓+CO2↑+H2O;
II(1)混合气体A经无水CaCl2吸收水蒸气,则水蒸气的质量为1.8g,n(H2O)=0.1mol;气体B通入稀硝酸酸化的硝酸银溶液产生白色沉淀,白色沉淀应为AgCl,则气体B为HCl,n(HCl)= n(AgCl)=![]() ,故混合气体A为水蒸气和HCl的混合气体;由绿色溶液C与氢氧化钠溶液反应生成蓝色沉淀知,蓝色沉淀为氢氧化铜,C中一定有铜离子,黑色固体M为CuO,CuO与气体B的浓溶液即浓盐酸反应生成氯化铜溶液,C为氯化铜溶液,n(CuO)=
,故混合气体A为水蒸气和HCl的混合气体;由绿色溶液C与氢氧化钠溶液反应生成蓝色沉淀知,蓝色沉淀为氢氧化铜,C中一定有铜离子,黑色固体M为CuO,CuO与气体B的浓溶液即浓盐酸反应生成氯化铜溶液,C为氯化铜溶液,n(CuO)=![]() ,则21.45g X隔绝空气加热分解生成0.1mol H2O,0.1mol HCl,0.2mol CuO,则X中n(Cu):n(O):n(H):n(Cl)=2:3:3:1,则X的化学式是Cu2(OH)3Cl;
,则21.45g X隔绝空气加热分解生成0.1mol H2O,0.1mol HCl,0.2mol CuO,则X中n(Cu):n(O):n(H):n(Cl)=2:3:3:1,则X的化学式是Cu2(OH)3Cl;
故答案为:Cu2(OH)3Cl;
(2)绿色溶液C为CuCl2溶液,蒸干后生成氢氧化铜和氯化氢,反应的方程式为CuCl2+2H2O![]() Cu(OH)2+2HCl,进一步灼烧得到固体M为CuO,反应的方程式为Cu(OH)2
Cu(OH)2+2HCl,进一步灼烧得到固体M为CuO,反应的方程式为Cu(OH)2![]() CuO+H2O,两步加合得到总反应的化学方程式是CuCl2+H2O
CuO+H2O,两步加合得到总反应的化学方程式是CuCl2+H2O![]() CuO+2HCl;
CuO+2HCl;
故答案为:CuCl2+H2O![]() CuO+2HCl;
CuO+2HCl;
(3)气体B为HCl,与氧气发生置换反应,则产物为氯气和水,根据得失电子守恒和元素守恒得该反应的化学方程式为4HCl+O2![]() 2H2O+2Cl2;
2H2O+2Cl2;
故答案为:4HCl+O2![]() 2H2O+2Cl2。
2H2O+2Cl2。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】下列有关乙烯和乙烷的说法中错误的是![]()
![]()
A. 乙烯是平面分子,乙烷分子中所有原子不可能在同一平面内
B. 溴的四氯化碳溶液和酸性![]() 溶液都可以鉴别乙烯和乙烷
溶液都可以鉴别乙烯和乙烷
C. 溴的四氯化碳溶液和酸性![]() 溶液都可以除去乙烷中混有的乙烯
溶液都可以除去乙烷中混有的乙烯
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:OH-、Na+、CrO![]() 、SO
、SO![]()
B.c(S2O![]() )=0.1mol·L-1的溶液中:Na+、K+、CO
)=0.1mol·L-1的溶液中:Na+、K+、CO![]() 、SO
、SO![]()
C.水电离出的c(H+)=1.0×10-13mol·L-1的溶液中:Na+、Mg2+、HSO![]() 、NO
、NO![]()
D.能使蓝色石蕊试纸变红的溶液中:Na+、NH![]() 、
、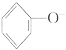 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活、生产息息相关,下列说法正确的是
A.氯水和食盐水消毒杀菌的原理相同
B.制造普通玻璃的原料为石英砂、石灰石和纯碱
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D.可以用钢瓶储存液氯和浓H2SO4,因为它们对钢瓶发生了钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室铝热反应的实验装置如下:
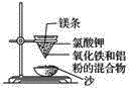
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 |
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯![]() 可用于制作食品包装袋,在一定条件下可通过乙烯生成聚乙烯,下列说法中正确的是( )
可用于制作食品包装袋,在一定条件下可通过乙烯生成聚乙烯,下列说法中正确的是( )
A. 燃烧等质量的乙烯和聚乙烯时,聚乙烯消耗的氧气多
B. 乙烯比乙烷的含碳量高,燃烧时容易产生浓烟
C. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D. 乙烯和聚乙烯都能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,0] 是最简单的一种,结构简式如图。下列关于该化合物的说法错误的是
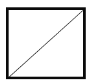
A.与1,3-丁二烯互为同分异构
B.一氯代物有2种,二氯代物共有4种(不考虑立体异构)
C.碳碳原子之间的夹角有45°和90°两种
D.与H2发生加成反应,生成1molC4H10理论上需要2molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际贸易可以互通有无,符合国际社会的根本利益,下列贸易商品中,主要成分属于无机物的是
A.巴西铁矿砂 | B.沙特石油 | C.俄罗斯天然气 | D.中国丝绸 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属都能与氧气反应:
(1)已知1.4 g锂在空气中加热充分反应,可生成3.0 g氧化物,写出该反应的化学方程式: ______。
(2)将一小块金属钠、钾分别投入到加热的坩埚中,观察到的实验现象是____________,有关反应的化学方程式是______________。
(3)由上述实验得出的结论是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com