
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。请回答下列问题:
(1)氨氮水体污染可用次氯酸除去,已知:
Ⅰ. ![]()
Ⅱ. ![]()
Ⅲ. ![]()
写出水体中![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式:____________________________。
的热化学方程式:____________________________。
(2)工业上可用排放的![]() 与
与![]() 合成尿素的方法,达到
合成尿素的方法,达到![]() 减排的目的:
减排的目的: ![]() 。
。
①一定条件下,在1L的密闭容器中充入1mol![]() 和一定量的
和一定量的![]() ,模拟工业生产得到
,模拟工业生产得到![]() 的平衡转化率(
的平衡转化率(![]() )随氨碳比
)随氨碳比 的变化如图所示,其他条件不变,
的变化如图所示,其他条件不变, ![]() 随
随![]() 增大而增大的原因是_______________________________________________;实际工业生产中氨碳比控制在4.0左右,而不是4.5的原因是____________________________________;该温度下反应的平衡常数
增大而增大的原因是_______________________________________________;实际工业生产中氨碳比控制在4.0左右,而不是4.5的原因是____________________________________;该温度下反应的平衡常数![]() ______________________________。
______________________________。

②若![]() ,在1L的恒容密闭容器中充入一定量的
,在1L的恒容密闭容器中充入一定量的![]() 和
和![]() ,此时体系压强为
,此时体系压强为![]() ,5min达到平衡时生成1mol
,5min达到平衡时生成1mol![]() ,此时容器内压强为
,此时容器内压强为![]() ,则用
,则用![]() 表示该反应的平均速率为______________________________,
表示该反应的平均速率为______________________________, ![]() 的平衡转化率为__________。
的平衡转化率为__________。
(3)采用电解法可使酸性废水中的![]() 转经为
转经为![]() 而除去,则阴极的电极反应式为________________________________________。
而除去,则阴极的电极反应式为________________________________________。
【答案】 ![]()
![]()
![]() 增大,
增大, ![]() 的浓度增大,
的浓度增大, ![]() 的平衡转化率增大 氨碳比在4.5时,
的平衡转化率增大 氨碳比在4.5时, ![]() 的量增大较多,而
的量增大较多,而![]() 的平衡转化率增大较少,提高了生产成本
的平衡转化率增大较少,提高了生产成本 ![]()
![]() 50%
50% ![]()
【解析】(1)已知:Ⅰ. ![]() ,Ⅱ.
,Ⅱ. ![]() ,Ⅲ.
,Ⅲ. ![]() ;根据盖斯定律,将Ⅰ×2+Ⅱ得
;根据盖斯定律,将Ⅰ×2+Ⅱ得![]()
![]() ,故答案为:
,故答案为: ![]()
![]() ;
;
(2) ①氨碳比 ,
, ![]() 增大,
增大, ![]() 的浓度增大,
的浓度增大, ![]() 的平衡转化率增大;实际工业生产中氨碳比控制在4.0左右,而不是4.5,是因为氨碳比在4.5时,
的平衡转化率增大;实际工业生产中氨碳比控制在4.0左右,而不是4.5,是因为氨碳比在4.5时, ![]() 的量增大较多,而
的量增大较多,而![]() 的平衡转化率增大较少,提高了生产成本;该温度下,氨碳比控制在4.0左右时,
的平衡转化率增大较少,提高了生产成本;该温度下,氨碳比控制在4.0左右时, ![]() 的平衡转化率为0.5,
的平衡转化率为0.5,
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
起始(mol/L)4 1 0 0
反应(mol/L)1 0.5 0.5
平衡(mol/L)3 0.5 0.5
平衡常数![]()
![]() =
=![]() ,故答案为:
,故答案为: ![]() 增大,
增大, ![]() 的浓度增大,
的浓度增大, ![]() 的平衡转化率增大;氨碳比在4.5时,
的平衡转化率增大;氨碳比在4.5时, ![]() 的量增大较多,而
的量增大较多,而![]() 的平衡转化率增大较少,提高了生产成本;
的平衡转化率增大较少,提高了生产成本; ![]() ;
;
②若![]() ,设充入的
,设充入的![]() 和
和![]() 分别为2xmol和xmol,
分别为2xmol和xmol,
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
起始(mol) 2x x 0 0
反应(mol) 2 1 1 1
平衡(mol)2x-2 x-1 1 1
平衡时容器内压强为起始时的![]() ,则气体的总物质的量为起始时的
,则气体的总物质的量为起始时的![]() ,即
,即![]() =
=![]() ,解得x=2,用
,解得x=2,用![]() 表示该反应的平均速率=
表示该反应的平均速率=![]() =0.4
=0.4![]() ,
, ![]() 的平衡转化率=
的平衡转化率=![]() ×100%=50%,故答案为:
×100%=50%,故答案为: ![]() ;50%;
;50%;
(3)采用电解法可使酸性废水中的![]() 转经为
转经为![]() 而除去,阴极上NO3-发生还原反应生成氮气,电极反应式为
而除去,阴极上NO3-发生还原反应生成氮气,电极反应式为![]() ,故答案为:
,故答案为: ![]() 。
。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①少量澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2
B.一定有CO、CO2和水蒸气
C.可能有CO2、NH3和水蒸气
D.一定有H2、CO2和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④ B.①②③④ C.①④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )

M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤干馏可获得重要的化工原料,应用非常广泛。将煤焦油中的苯、甲苯与苯酚进行分离,可采取:

(Ⅰ)①和⑤的化学式:①_______、⑤_______。
(Ⅱ)分离方法:②_______、③_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾成因有多种,其中燃煤过程中产生的二氧化硫、氮氧化物以及可吸入颗粒物是山西冬季雾霾的主要组成。治霾迫在眉睫,利在千秋。
I.脱氮
已知: ①2CO(g)+O2(g)===2CO2(g) ΔH1=-566.0 kJ·mol-1
②2NO(g)+O2===2NO2(g) ΔH2=-116.5kJ·mol-1
③N2(g)+O2(g)===2NO(g) ΔH3=+180.5kJ·mol-1
(1)则燃煤所产生的废气中NO2 与CO 转化成无污染气体的热化学方程式为:________________________________。
(2)若1molN2(g)1mo1O2(g)分子中化学键断裂时分别吸收946kJ、498KJ的能量,则1mo1NO(g) 分子中化学键断裂时需要吸收的能量为_____________________KJ。
Ⅱ.脱硫的反应原理2CO(g) +SO2(g)![]() 2CO2(g) +S(1) ΔH=-QkJ·mol-1(Q>0)
2CO2(g) +S(1) ΔH=-QkJ·mol-1(Q>0)
(1)若在一定温度下,将总物质的量为3 mol的CO(g)和SO2(g) 以不同比例充入2 L的恒容容器中,结果如图所示。a、b分别表示SO2、CO的平衡转化率的变化,c表示平衡体系中CO2的体积分数的变化。
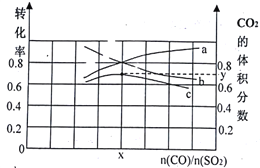
由图计算x=__________;CO2的体积分数y=_________(精确到0.01),该温度下的平衡常数K=_____。
(2)在T1℃下,将CO与SO2按体积比为5∶4充入一恒压密闭容器中,此时容器体积为0.1V L。
①下列能判断该反应达到化学平衡状态的是_____________。
a.S(l)的质量不变
b.K不变
c.容器中气体的平均相对分子质量不变
d.2v正(SO2)= v正(CO2)
e.Q值不变
②压强一定的条件下,在不同温度下进行反应,测得容器的体积变化如图所示:
已知: n1≠n2
温度(℃) | 初始投入总量 | 初始投料v (CO) /v (SO2) | 初始体积(L) | 平衡体积(L) |
T1 | n1 | 5∶4 | 0.1v | 0.07v |
T2 | n2 | 5∶4 | 0.3v | 0.22v |
求:T1温度时,SO2的平衡转化率为_____%;
比较大小,T1___T2(填“>”、“<”、“=”),解释原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验中,不能达到相应实验目的的是

A.装置甲:气体从b口进入,收集Cl2
B.装置乙:可制得金属锰
C.装置丙:实验室制取乙酸乙酯
D.装置丁:验证HCl气体在水中的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.将浓硫酸转移至容量瓶中,加水稀释至距标线2~3 cm处,改用胶头滴管定容
B.用酒精萃取碘水中的碘单质
C.进行液体蒸馏实验时,冷凝管中应充满自来水
D.某溶液加入盐酸酸化的氯化钡溶液后,出现白色沉淀,则原溶液中必有SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:

(1)A的名称是____________;F的化学式是 _____________。
(2)B→D反应的化学方程式__________________________________。
(3)F在空气中遇水蒸气产生白雾现象,这白雾实际上是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com