

 .
. 分析 E能使湿润的红色石蕊试纸变蓝,应为NH3,I为红棕色,应为NO2,则H为NO,J为HNO3,F为无色无味,且能使澄清石灰水变混浊,则应为CO2,C、G、K的焰色反应呈黄色,则都含有Na元素,由反应③可知G为Na2CO3,K为NaHCO3,C应为NaOH,A是一种常见的肥料,应为NH4HCO3,B、E在空气中相遇会产生白烟,可知B应为HCl,则D为NH4Cl,结合题目分析解答.
解答 解:(1)由以上分析可知D为NH4Cl,故答案为:NH4Cl;
(2)反应③为Na2CO3与CO2反应生成NaHCO3的反应,反应的方程式为Na2CO3+CO2+H2O=2NaHCO3,故答案为:Na2CO3+CO2+H2O=2NaHCO3;
(3)反应④为Cu和HNO3的反应,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)反应⑤为3NO2+H2O═2HNO3+NO,该反应中,只有氮原子化合价变化,电子转移的方向和数目为 ,
,
故答案为: .
.
点评 本题考查无机物的推断,题目难度不大,本题注意意把握常见物质的颜色以及常见反应为解答该题的关键,注意把握相关物质的性质及物质之间的转化,注意基础知识的积累.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:实验题

 2AlCl3
2AlCl3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢是铁合金,钢的含碳量低于生铁,性能优于生铁 | |
| B. | 金属具有的物理通性是延展性、导热性、银白色光泽、导电性 | |
| C. | 符号Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质 | |
| D. | 焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120℃,将wg甲醛在足量空气中燃烧,将生成产物用固体Na2O2(过量)吸收,固体增重wg | |
| B. | 24gMg带在足量CO2气体中燃烧,生成固体质量为40g | |
| C. | 相同物质的量的Al、Al2O3、Al(OH)3与足量NaOH溶液反应,溶液增重相等 | |
| D. | 在Fe3O4与足量浓硝酸的反应中,参加反应的Fe3O4与体现酸性的HNO3物质的量之比为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
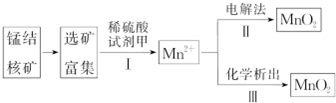
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 2.0g | 20℃ | |
| Ⅱ | 5% | 1.0g | 20℃ | |
| Ⅲ | 10% | 1.0g | 20℃ | |
| Ⅳ | ω | 2.0g | 30℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com