

| A. | A的所有原子都在一个平面内 | B. | 反应①是加成反应 | ||
| C. | 反应②是消去反应 | D. | A的二取代产物只有1种 |
分析 A.碳碳双键之间的碳原子能共平面,亚甲基具有甲烷结构特点;
B.该反应符合加成反应条件;
C.先根据卤代烃的水解,然后根据同一个碳上连有两个羟基时要脱水;
D.环丙叉环丙烷二卤取代物先判断一氯代物的种类,然后再根据一卤代物中氢原子的种类来确定二卤取代产物的数目.
解答 解:A.由于环丙烷的环并不是平面结构,所以分子中所有的原子不可能都在同一平面内,故A错误.
B.环丙叉环丙烷中双键断裂,两个碳原子上共结合一个基团,所以属于加成反应,故B正确;
C.物质B为卤代烃,卤代烃要发生水解,生成醇,根据同一个碳上连有两个羟基时要脱水,最终生成物质C,故反应的类型先是取代反应后为消去反应,故C错误;
D.环丙叉环丙烷分子中的4个“CH2”完全等同,只有一种氢原子,所以一卤代物只有一种,一卤代物中只有4种氢原子,所以的环丙叉环丙烷二卤代物有4种: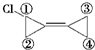 ,故D错误;
,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查了反应的类型、原子共面、以及取代产物的数目的判断,难度中等,需要注意的是考查学生同一个碳上连有两个羟基时要脱水.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油 | B. | 电石 | C. | 衣物 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排饱和食盐水法收集Cl2 Cl2+H2O?H++Cl-+HClO | |
| B. | 纯碱溶液加热使溶液碱性增强CO32-+2H2O?H2CO3+2OH- | |
| C. | 向Mg(OH)2悬浊液中加入FeCl3溶液,悬浊液颜色改变3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+ | |
| D. | 配制FeCl3溶液时,为防止溶液浑浊,常将FeCl3固体溶解于浓盐酸,再加水稀释Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤块粉碎后燃烧 | |
| B. | 用2mol/L的盐酸代替1mol/L的盐酸制取氢气 | |
| C. | 将食物贮藏在冰箱中 | |
| D. | 用H2O2溶液制取氧气时加入少量二氧化锰粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com