
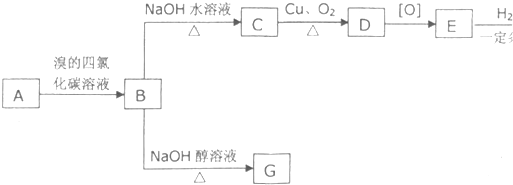
| 2×8+2-8 |
| 2 |
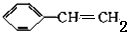 ,A加成生成B,B的结构简式为:
,A加成生成B,B的结构简式为: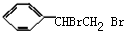 ,B和氢氧化钠的醇溶液发生消去反应生成G,G最多可与4molH2加成,则G的结构简式为
,B和氢氧化钠的醇溶液发生消去反应生成G,G最多可与4molH2加成,则G的结构简式为 或
或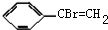 ,B和氢氧化钠的水溶液发生取代反应生成C,C的结构简式为:
,B和氢氧化钠的水溶液发生取代反应生成C,C的结构简式为: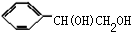 ,C被氧化生成D,D的结构简式为:
,C被氧化生成D,D的结构简式为: ,D被氧化生成E,E的结构简式为
,D被氧化生成E,E的结构简式为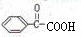 ,E和氢气发生加成反应生成F,F的分子式为C8H8O3,则F的结构简式为:
,E和氢气发生加成反应生成F,F的分子式为C8H8O3,则F的结构简式为: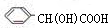 ,结合物质的结构和性质解答.
,结合物质的结构和性质解答.| 2×8+2-8 |
| 2 |
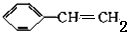 ,A加成生成B,B的结构简式为:
,A加成生成B,B的结构简式为: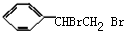 ,B和氢氧化钠的醇溶液发生消去反应生成G,G最多可与4molH2加成,则G的结构简式为
,B和氢氧化钠的醇溶液发生消去反应生成G,G最多可与4molH2加成,则G的结构简式为 或
或 ,B和氢氧化钠的水溶液发生取代反应生成C,C的结构简式为:
,B和氢氧化钠的水溶液发生取代反应生成C,C的结构简式为: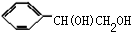 ,C被氧化生成D,D的结构简式为:
,C被氧化生成D,D的结构简式为: ,D被氧化生成E,E的结构简式为
,D被氧化生成E,E的结构简式为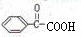 ,E和氢气发生加成反应生成F,F的分子式为C8H8O3,则F的结构简式为:
,E和氢气发生加成反应生成F,F的分子式为C8H8O3,则F的结构简式为: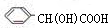 ,
, ,故答案为:
,故答案为: ;
; 或
或 ,则G所含官能团(不包括苯基)的名称溴原子和碳碳双键,故答案为:溴原子和碳碳双键;
,则G所含官能团(不包括苯基)的名称溴原子和碳碳双键,故答案为:溴原子和碳碳双键; ,
, ;
;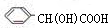 ,F的同分异构体符合下列条件,
,F的同分异构体符合下列条件,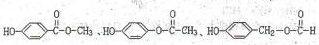 ,
, .
.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
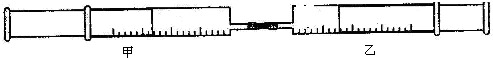
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒现象 |
| 1 | 10mlFeSO4 | 10mlNH3 | 生成白色沉淀,后变色 |
| 2 | 15mlCl2 | 40mlNH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
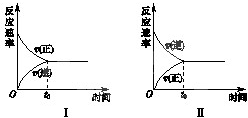 t℃时,在两个相同的密闭刚性容器(恒容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)?2SO3(g),实验Ⅰ和实验Ⅱ的情况分别如图Ⅰ和图Ⅱ所示:
t℃时,在两个相同的密闭刚性容器(恒容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)?2SO3(g),实验Ⅰ和实验Ⅱ的情况分别如图Ⅰ和图Ⅱ所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、NO3-、Cl- |
| B、Na+、Zn2+、OH-、Br- |
| C、K+、SO42-、Cl-、Mg2+ |
| D、Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
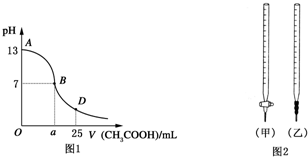 Ⅰ.如图1为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:
Ⅰ.如图1为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 石蕊 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com