
【题目】一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
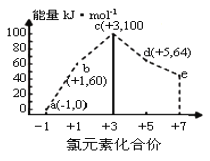
A.b→a+c反应的活化能为生成物总能量减反应物总能量
B.b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq) ΔH=-116kJmol-1
C.a、b、c、d、e中,c最稳定
D.一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶2∶1
科目:高中化学 来源: 题型:
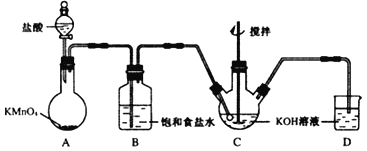
【题目】高铁酸钾(K2FeO4)是一种绿色高效水处理剂.某学习小组用图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4.
查阅资料知K2FeO4的部分性质如下:
①溶于水、微溶于浓KOH溶液
②在0℃~5℃、强碱性溶液中比较稳定
③Fe3+和Fe(OH)3催化作用下发生分解
④酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2.
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的作用是__.
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3.为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是__.
(3)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式__.
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质.
提纯方案:
将一定量的K2FeO4粗产品溶于冷的3mol/L KOH溶液中,用砂芯漏斗(硬质高硼玻璃)过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥.
第一次和第二次过滤得到的固体分别对应的是(填化学式)__、__,过滤时不用普通漏斗而采用砂芯漏斗的原因是(用离子方程式说明)__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )
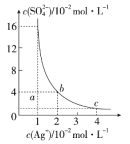
A.b点对应的Ksp等于c点对应的Ksp
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(molL-1)3
D.0.02molL-1的AgNO3溶液与的0.2molL-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂钡氧化物二次电池。电池总反应为V2O4+xLi![]() LixV2O4,下列说法正确的是
LixV2O4,下列说法正确的是
A. 该电池充电时,锂极与外电源的负极相连
B. 该电池放电时,Li+向负极移动
C. 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+
D. 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1molA和1molB在一个容积可变的容器中发生反应:A(g)+2B(g)![]() 2C(g)。一段时间后达到平衡,生成amolC。下列说法不正确的是( )
2C(g)。一段时间后达到平衡,生成amolC。下列说法不正确的是( )
A.起始时和达到平衡时容器中的压强之比为1:1
B.平衡时物质A、B的转化率之比为1:2
C.平衡时A的转化率为![]()
D.当v正(A)=v逆(B)时,可判定反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反
D.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是( )mol/L
A. 0.15 B. 0.225 C. 0.35 D. 0.45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式,回答下列问题:
①2H2(g)+O2(g)=2H2O(l) ΔH=﹣570kJ![]()
②2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ![]()
③2C(s)+O2(g)=2CO(g) ΔH=﹣220.8kJ![]()
④C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ![]()
(1)上述反应中属于放热反应的是_____(填写序号);
(2)H2的燃烧热为_____;
(3)燃烧8g H2生成液态水,放出的热量为_____;
(4)H2O(l)=H2O(g)ΔH=______;
(5)CO的燃烧热的热化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个容积均为![]() 的恒容密闭容器中反应
的恒容密闭容器中反应![]() 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是
容器 | 温度 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| ||
Ⅰ | 400 |
|
| 0 |
|
Ⅱ | 400 |
|
| 0 |
|
Ⅲ | 500 |
|
| 0 |
|
A. 该反应的正反应是吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小
C. 达到平衡时,容器Ⅱ中![]() 小于容器Ⅲ中
小于容器Ⅲ中![]()
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com