
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| 1mol?L-1×1mol?L-1 |
| 0.5mol?L-1×1.5mol?L-1 |
| (1-x)×(1-x) |
| (0.5+x)×(1.5+x) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、CH3(CH2)5CH3 |
| B、C(CH3)4 |
| C、(CH3CH2)2CHCH3 |
| D、(CH3)2CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 |
T/℃ | NO初始浓度 (mol?L-1) |
CO初始浓度 (mol?L-1) |
催化剂的比表面积 ( m2?g-1) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
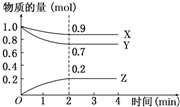 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答:
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、烧杯中有气泡产生 |
| B、试管内有黄绿色气体产生 |
| C、铁丝网的表面产生锈迹 |
| D、烧杯内溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .下列有关物质的推断不正确的是( )
.下列有关物质的推断不正确的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为SO2,则丁可能是氨水 |
| C、若甲为AlCl3,则丁可能是浓氨水 |
| D、若甲为NaOH 溶液,则丁可能是CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com