
A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式 。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为 。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为____________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是_________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是 。
(1)NH3
(2)H2O2+OH-=HO2-+H2O HO2-+OH-=H2O+O22- (或H2O2+2OH-=O22-+2H2O)
(3)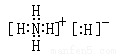
(4)NH4NO2+AgNO3=AgNO2↓+NH4NO3 c(NO2-)>c(NH4+)>c(H+)>c(OH-)
(5)HS-+OH-=S2-+H2O
【解析】根据元素的结构及有关性质可知,A、B、C、D、E五种元素分别是H、N、O、Na、S。
(1)NH3的沸点比H2S的要高。
(2)过氧化氢可以看作是二元弱酸,所以和氢氧化钠反应的方程式为H2O2+2OH-=O22-+2H2O。
(3)H和N要形成离子化合物,则只能是氢化铵,其电子式为
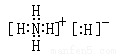
(4)硝酸银易溶于水,所以白色沉淀应该是亚硝酸银,方程式为NH4NO2+AgNO3=AgNO2↓+NH4NO3;溶液显酸性,说明NH4+的水解程度大于NO2-的水解程度,所以离子浓度大小顺序是c(NO2-)>c(NH4+)>c(H+)>c(OH-)。
(5)根据XY的性质及组成结构特点可知,X是NaOH,Y是NaHS,二者反应的方程式为HS-+OH-=S2-+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考名师推荐化学乙醇和乙酸(解析版) 题型:选择题
某有机物的化学式为C4H8O3,现有0.1 mol该有机物分别与足量的钠、足量的碳酸氢钠溶液反应,生成标准状况下的气体分别为2.24 L H2、2.24 L CO2。则该有机物的同分异构体有(不考虑立体异构)
A.3种 B.4种C.5种D.6种
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的值。下列叙述中不正确的是
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4L氯气于足量的镁粉反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列结论能够成立的是
A.0.1 mol·L-1的Na2CO3溶液中含有CO32-的个数是小于0.1NA
B.1 molFe与足量稀硝酸完全反应转移的电子数为2NA
C.0.2mol·L-1 CuSO4溶液加水稀释至体积增加1倍,其浓度变为0.1 mol·L-1
D.4g NaOH固体溶解1L水中,所得溶液的物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+物质的量浓度(mol·L-1)为
A. B.
B. C.
C.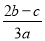 D.
D.
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
A、离子半径:Na+>N3->H+
B、反应①和②都是氧化还原反应
C、反应②每生成1 mol H2,转移的电子数为NA
D、Na3N和NaH与盐酸反应都只生成一种盐
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
下列关于有机物的叙述不正确的是
A.甲烷、甲苯、乙醇、乙酸都可以发生取代反应
B.煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏制取
C.乙酸乙酯在无机酸或碱存在时都能发生水解反应
D.淀粉、纤维素、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g) +4H2O(g) ΔH=-1135.7kJ/mol,
下列说法正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
下列表达不正确的是
A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS-  H++S2-
H++S2-
B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl)
C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-)
D.同浓度的下列溶液中,c (CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com