
【题目】由短周期主族元素X,Y,Z组成的单质(化学式也分别为X,Y,Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,晶体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( ) 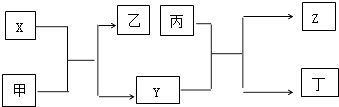
A.X为第三周期Π族元素,Y和Z位于同一主族
B.甲、乙、丙均能与水发生化合反应
C.晶体甲、乙、丙分别分子晶体、离子晶体和原子晶体
D.X可用于制焰火烟花,丙可用于作太阳能电池的材料
【答案】C
【解析】解:甲和丁为无色的气体,晶体甲可用于人工降雨,则甲为CO2 , X为金属,其核外电子数为Y原子序数的2倍,X与甲反应生成乙和Y,所以X为Mg,Y为C,则乙为MgO,Y的最低负化合价与Z的最高正化合价的数值相等,则Z为Si,丙为二氧化硅,碳与二氧化硅反应生成一氧化碳和硅,所以丁为CO,
A、根据上面的分析可知,X为Mg,所以X为第三周期ⅡA族元素,Z为Si,Y和Z不位于同一主族,故A错误
B、氧化镁和二氧化硅均不能与水发生化合反应,故B错误;
C、晶体二氧化碳、氧化镁、硅分别分子晶体、离子晶体和原子晶体,故C正确;
D、X为Mg,X可用于制焰火烟花,丙为二氧化硅,丙不可用于作太阳能电池的材料,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水中的电离方程式
碳酸氢钠______________________________________________________________。
亚硫酸________________________________,______________________________。
(2)已知25 ℃时有关弱酸的电离平衡常数如下:HCN:4.9×10-10,H2CO3:K1=4.4×10-7 K2=4.7×10-11,向NaCN溶液中通入少量二氧化碳气体,写出发生反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量一定是中和热
C.由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯气的叙述中,下列说法正确的是
A. 氯气是一种黄绿色、有毒的气体
B. 氯气可以与铁反应生成FeCl2
C. 氯气不能溶于水,所以可用排水法收集氯气
D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下。
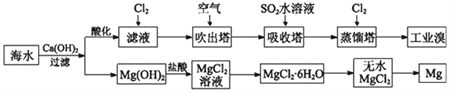
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是_____________________,吸收塔中发生反应的离子方程式是___________________________________。用平衡移动原理解释通空气的主要目的是:____________________________。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是______、____、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学通过查阅资料,获得了草酸的一些信息,整理出下表。
结构简式 | HOOC-OOH |
溶解性 | 能溶于水,易溶于乙醇 |
特性 | 大约在157℃升华(175℃以上发生分解) |
化学性质 | H2C2O4+Ca(OH)2=CaC2O4↓+2H2O |
HOOC-COOH | |
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2↑+8H2O |
(1)该组同学欲通过实验验证草酸受热分解产物中的CO2和CO(装置符合气密性要求,其他试剂可选)。

①填写表中空内。
仪器 | A | B | C |
加入试剂 | ________ | ________ | NaOH溶液 |
②简述检验CO的实验方法和实验现象__________________。
(2)实验室常用草酸钠测定KMnO4溶液的浓度。
①准确称取2.680g草酸钠,溶于稀硫酸和水制成100.0 mL溶液,每次取20.00mL溶液于锥形瓶中;将待测KMnO4溶液置于_______________(填“酸式”或“碱式”)滴定管中进行滴定。重复上述滴定操作三次,实验数椐如下表所示。待测KMnO4溶液的物质的量浓度为____________。
滴定前均为 | 第一次终点 | 第二次终点 | 第三次终点 | |
滴定管液面刻度 | 0.00 mL | 20.02mL | 21.00mL | 19.98mL |
②将酸性KMnO4溶液和H2C2O4溶液混合后,发现开始时溶液褪色不明显,但不久后迅速褪色,针对该实验现象,某同学认为KMnO4溶液与H2C2O4溶液的反应是放热反应,导致溶液温度升高,反应速率加快。你猜想还有可能是_____________的影响。若用实验证明你的猜想,除KMnO4溶液、H2C2O4溶液、稀硫酸外,还需要选择的合理试剂是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)__________________,设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。

(2)用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式___________,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO![]() ,试写出该反应的离子方程式____________________。
,试写出该反应的离子方程式____________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是溶液变红,电极反应为______________;乙装置中石墨(1)为________极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为________________。

(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为__________________________、__________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com