
| A. | 氯水应保存在棕色试剂瓶内:2HClO$\frac{\underline{\;光照\;}}{\;}$H2O+Cl2↑ | |
| B. | 氯水具有杀菌、漂白作用:Cl2+H2O?HCl+HClO | |
| C. | 将氯水滴到淀粉KI试纸上,试纸变蓝:Cl2+2I-=2Cl-+I2 | |
| D. | 在实验室用漂白液和适量稀盐酸制取少量氯水:ClO-+Cl-+2H+=Cl2+H2O |
分析 A、氯水中的次氯酸不稳定,见光易分解;
B、氯水中的次氯酸因为具有氧化性而具有杀菌、漂白作用;
C、氯气具有氧化性,能将碘离子氧化为碘单质,碘单质遇到淀粉变蓝;
D、漂白液和适量稀盐酸之间发生氧化还原反应可以得到氯气,据此回答.
解答 解:A、氯水中的次氯酸不稳定,见光易分解2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,故A不合理;
B、氯水中的次氯酸因为具有氧化性而具有杀菌、漂白作用,即Cl2+H2O?HCl+HClO,故B合理;
C、氯气具有氧化性,能将碘离子氧化为碘单质Cl2+2I-=2Cl-+I2,碘单质遇到淀粉变蓝,极将氯水滴到淀粉KI试纸上,试纸变蓝,故C合理;
D、漂白液和适量稀盐酸之间发生氧化还原反应可以得到氯气,原理是:ClO-+Cl-+2H+=Cl2+H2O,故D合理.
故选A.
点评 本题考查了物质性质,离子方程式书写和正误分析判断,主要是氧化还原反应产物的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
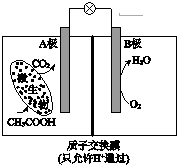
| A. | 外电路电子从B极移向A极 | |
| B. | 溶液中H+由B极区移向A极区 | |
| C. | 电池工作一段时间后B极区溶液的pH减小 | |
| D. | A极电极反应式为:CH3COOH-8e-+2H2O=2CO2+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
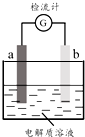 30℃时,利用图装置进行实验,结果记录如下表所示:
30℃时,利用图装置进行实验,结果记录如下表所示:| 实验 | a电极 | b电极 | 电解质溶液 | 现象 |
| I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅱ | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅲ | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
| Ⅳ | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
| A. | Ⅱ中Al为负极,其电极反应是:Al-3e-═Al3+ | |
| B. | Ⅱ中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行 | |
| C. | Ⅳ中Fe为负极,发生了氧化反应 | |
| D. | 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:r(Z2+)>r(Y2-) | |
| B. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物强 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | X、Y、Z、W元素的最高正价均等于其所在族的族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
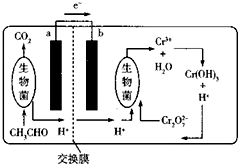 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )| A. | b极为正极,发生还原反应 | |
| B. | 负极的电极反应式为CH3CHO-10e-+3H2O═2CO2↑+10H+ | |
| C. | 理论上处理l mol Cr2O72-时有l4mool H+从交换膜左侧向右侧迁移 | |
| D. | 放电时,交换膜右侧生物菌周围溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
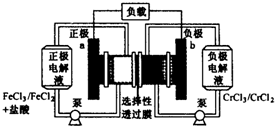 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )| A. | 电池充电时,b极的电极反应式为Cr3++e-=Cr2+ | |
| B. | 电池充电时,Cl-从a极穿过选择性透过膜移向b极 | |
| C. | 电池放电时,a极的电极反应式为Fe3++3e-=Fe | |
| D. | 电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当滴入20mL NaOH溶液时:c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| D. | 当滴入30mL NaOH溶液时,所得溶液pH>7:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com