
分析 氯化亚铁可有氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化;
氯化铁与氢氧化钠反应生成氢氧化铁;
氯化铁与KSCN发生络合反应;
氯化铝与氢氧化钠溶液反应生成氢氧化铝,氢氧化钠过量,继续反应生成偏铝酸钠.
解答 解:氯化亚铁可有氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,可观察到先白色沉淀,很快变成灰绿色,最终变成红褐色;
氯化铁与氢氧化钠反应生成氢氧化铁,可观察到生成红褐色沉淀;
氯化铁与KSCN发生络合反应,溶液变为血红色;
氯化铝与氢氧化钠溶液反应生成氢氧化铝,氢氧化铝为两性氢氧化物,氢氧化钠过量,继续反应生成偏铝酸钠,可观察到沉淀溶解.
故答案为:先白色沉淀,很快变成灰绿色,最终变成红褐色;生成红褐色沉淀;溶液变成血红色;先生成白色沉淀后沉淀溶解.
点评 本题考查元素化合物知识,为高频考点,侧重考查学生的分析能力以及元素化合物知识的综合理解和运用,注意把握常见物质的性质,难度不大.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2 (g)+O2(g)=2H2O(l) | B. | H2(g)+Cl2 (g)=2HCl(g) | ||
| C. | (NH4)2CO3(s)=NH4HCO3 (s)+NH3(g) | D. | Cu(s)+Cl2 (g)=CuCl2 (s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O??H3O++S2- | |
| C. | 硫化钾水解:S2-+H2O═HS-+OH- | |
| D. | 硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO2-+6H2O═4Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
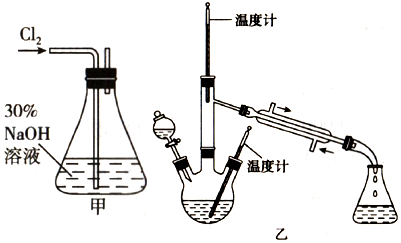 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中,负极上消耗1 mol甲醛时转移2 mol电子 | |
| B. | ①溶液中的H+由正极移向负极 | |
| C. | 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4 | |
| D. | ④中,甲醛浓度越大,吸光度越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系 | |
| B. | 在光照情况下,一定体积的饱和氯水的pH(Y)随时间(X)的关系 | |
| C. | 100℃,1个大气压下,按体积比1:1混合的CO2和H2O(g)混合气通过足量Na2O2粉末,固体增加的质量(Y)与混合气体积(X)的关系 | |
| D. | 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3 的物质的量(Y)与消耗NaOH的物质的量(X)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝锂合金的硬度大于纯铝、熔点低于锂单质 | |
| B. | 改变原料的配比,可以制得性能不同的铝锂合金 | |
| C. | 铝锂合金的性质与各成分金属的性质完全相同 | |
| D. | 铝锂合金优点是密度较小、强度较大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com