
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:

下列说法不正确的是
A.反应前2 min的平均速率υ(Z)=2.0×10—3mol/(L·min)
B.其他条件不变,升高温度,反应达到新平衡前υ(逆)>υ(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源:2014-2015浙江省杭州市下学期高二4月月考化学试卷(解析版) 题型:选择题
有机物C4H8Cl2的同分异构体中只含一个“—CH3”的有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列试剂不能跟HCHO反应的是
①Ag(NH3)2OH ②新制Cu(OH)2 ③O2 ④KMnO4酸性溶液 ⑤CH3CH2OH
A.①②③ B.④⑤ C.④ D.⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:简答题
(13分)(1)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) 2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。

①该反应的平衡常数表达式为K=___。升高温度,平衡常数将____(填“增大”“减小 ”或“不变”)。
”或“不变”)。
②能判断该反应是 否达到化学平衡状态的依据是________。
否达到化学平衡状态的依据是________。
A.容器中压强不 变
变
B.混合气体的密度不变
C.υ(A):υ(B):υ(C)=2:1:2
D.c(A)=c( C)
C)
(2)为研究不同条件对反应2NO(g)+Cl2(g) 2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为
2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为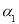 。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为
。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为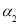 ,则
,则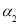 __________
__________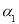 ,(填“大于”“小于”或“等于”)。
,(填“大于”“小于”或“等于”)。
(3)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2—离子。电池工作时负极反应式为_________________。用该燃料电池作电源,以石墨为电极电解足量的硫酸铜溶液,当电路中通过0.1 mol电子时,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____(填物质名称),其 质量约为_______g。
质量约为_______g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
下列有关元素的性质及其递变规律正确的是
A. 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4 L气体
B.2 L 0.05 mol/L乙酸溶液中H+数为0.1NA
C.等物质的量的Na2O和Na2O2中含有的阴离子总数不同
D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第二次模拟化学试卷(解析版) 题型:填空题
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有 (填序号)

A:σ键
B:π键
C:氢键
D:配位键
E:分子间作用力
F:金属键
G:离子键
(2)下面关于晶体的说法不正确的是___________
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)
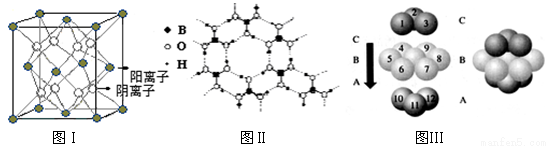
①图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;
②H3BO3晶体中B原子杂化方式______;
③三种晶体中熔点高低的顺序为 (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为_______________。
(4)碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示)。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:推断题
(15分)化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下:

请回答下列问题:
(1)化合物C中含氧官能团为________、________(填名称)。
(2)化合物B的分子式为C16H13O3Br,则B的结构简式为____________。
(3)由C→D、E→F的反应类型依次为________、________。
(4)写出符合下列条件C的一种同分异构体的结构简式:______________。
Ⅰ.属于芳香族化合物,且分子中含有2个苯环;
Ⅱ.能够发生银镜反应;
Ⅲ.分子中有5种不同环境的氢原子。
(5)已知:RCl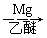 RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、 为原料制备
为原料制备 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
H2C=CH2  CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com