
| A. | a→b→e→c→d | B. | b→e→a→d→c | C. | a→e→b→c→d | D. | a→d→b→e→c |
分析 碘离子具有氧化性,能被氧化剂氧化为碘单质,碘单质遇到淀粉变蓝色,碘单质的水溶液是棕黄色的溶液,单质碘可以和强碱之间发生反应,类似氯气和氢氧化钠之间的反应,得到的是无色溶液.
解答 解:根据题意知道:①无色:A、B、C均为无色;②棕黄色:暗示有I2生成,碘离子具有氧化性,能被氧化剂氯气氧化为碘单质,故先加KI溶液,再加氯水置换出I2;③碘单质遇到淀粉变蓝色,所以蓝色说明加氯水后加淀粉溶液;④单质碘可以和强碱之间发生反应,得到的是无色溶液,所以溶液无色说明I2不再存在,那么加入的是NaOH溶液,最后再次出现蓝色,说明再次出现碘单质,应该是前边加入氢氧化钠后生成的碘化钠、碘酸钠在硫酸作用下发生反应生成碘单质的缘故,即最后加入的是硫酸,故选C.
点评 本题目综合考查学生物质的化学性质以及反应中的现象等知识,注意知识的归纳和整理是关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应是放热反应 | |
| B. | 合成氨反应是熵减小的反应 | |
| C. | 合成氨反应在任何条件下都可自发进行 | |
| D. | 降低温度、增大压强都有利于平衡向生成氨的方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用、制备有毒气体应在通风橱中进行,应有尾气吸收处理装置 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50 mL量筒中配制0.100 0 mol•L-1碳酸钠溶液 | |
| D. | 汞洒落后,应立即撒上硫粉,并打开墙下面的排气扇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | NaOH和NaCl | C. | NH4Cl 和HCl | D. | H2O2和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
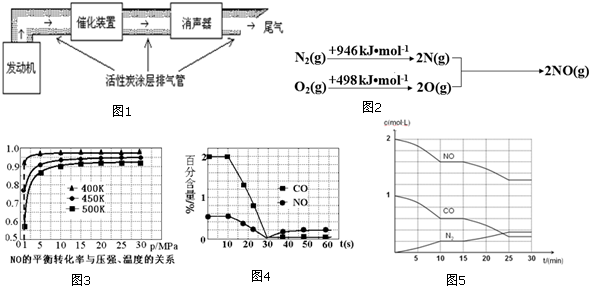
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com