

 .
. .
. ,
, 、
、 .(写两种即可)
.(写两种即可) 分析 1molC与Na完全反应生成1molH2,若1molC与NaHCO3完全反应,也产生1mol气体,说明C中含有1个-COOH和1个-OH,且位于对位位置,且C氧化产物能发生银镜反应,结合A的结构特点和分子式可知C应为 ,则A为
,则A为 ,B为
,B为 ,D为
,D为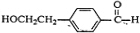 ,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为
,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为 ,其相对分子质量为148,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物,结合有机物的结构和性质解答该题.
,其相对分子质量为148,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物,结合有机物的结构和性质解答该题.
解答 解:1molC与Na完全反应生成1molH2,若1molC与NaHCO3完全反应,也产生1mol气体,说明C中含有1个-COOH和1个-OH,且位于对位位置,且C氧化产物能发生银镜反应,结合A的结构特点和分子式可知C应为 ,则A为
,则A为 ,B为
,B为 ,D为
,D为 ,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为
,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为 ,
,
(1)由以上分子可知,D为 ,含氧官能团是醛基和羧基,A的结构简式是
,含氧官能团是醛基和羧基,A的结构简式是 ,
,
故答案为:醛基、羧基; ;
;
(2)反应④为C的消去反应;反应⑤为C发生缩聚反应生成高分子化合物,反应的方程式为 ,
,
故答案为:消去; ;
;
(3)与C取代基位置相同,既能与FeCl3溶液显色,说明含有酚羟基,又能发生水解反应,说明含有酯基,对应的同分异构体有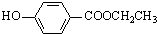 、
、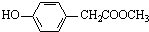 、
、 ,
,
故答案为: (其中两种).
(其中两种).
点评 本题考查有机物的推断,题目难度中等,本题注意根据根据题给信息,以C为推断该题的突破口,难点是同分异构体的判断,注意把握题给信息以及判断同分异构体的方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.金属的腐蚀主要有两种形式:化学腐蚀和电化学腐蚀,其中电化学腐蚀是金属腐蚀的主要形式.如图是钢铁在空气中发生电化学腐蚀(吸氧腐蚀)的简单图示.试分析下列问题:
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.金属的腐蚀主要有两种形式:化学腐蚀和电化学腐蚀,其中电化学腐蚀是金属腐蚀的主要形式.如图是钢铁在空气中发生电化学腐蚀(吸氧腐蚀)的简单图示.试分析下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒•夏特列原理.请回答下列问题:
中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒•夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 滴加紫色石蕊溶液显红色的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 是酸性氧化物,能与氢氟酸反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为9﹕5 | |
| C. | 若反应中转移的电子为n mol,则0.20<n<0.30 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-13 mol•L-1的溶液中:Na+、Mg2+、I-、SO42- | |
| B. | 0.1mol•L-1的明矾溶液中:K+、NH4+、Cl-、HCO3- | |
| C. | pH=1的溶液中:Na+、NH4+、MnO4-、S2O32- | |
| D. | 无色透明的溶液中:Na+、Ba2+、Br-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com