
| A. | VA=0.15 mol•L-1•min-1 | B. | VC=0.6 mol•L-1•min-1 | ||
| C. | VB=0.6 mol•L-1•min-1 | D. | VD=0.1 mol•L-1•min-1 |
分析 在单位相同的条件下,将不同物质的反应速率除以其计量数,得到的数值越大说明该反应速率越大,据此分析解答.
解答 解:A.$\frac{v(A)}{1}$=$\frac{0.15}{1}$mol•L-1•min-1=0.15mol•L-1•min-1;
B.$\frac{v(C)}{2}$=$\frac{0.6}{2}$mol•L-1•min-1=0.3mol•L-1•min-1;
C.$\frac{v(B)}{3}$=$\frac{0.6}{3}$mol•L-1•min-1=0.2mol•L-1•min-1;
D.$\frac{v(D)}{2}$=$\frac{0.1}{2}$mol•L-1•min-1=0.05mol•L-1•min-1,
通过以上计算知,反应速率大小顺序是B>C>A>D,所以反应最快的是B,
故选B.
点评 本题考查化学反应速率大小比较,侧重考查学生分析判断能力,在比较快慢之前单位要统一,可以将不同物质转化为统一物质比较,也可以将反应速率除以其计量数比较,题目难度不大.


科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| B. | 硫酸与氢氧化镁溶液:H++OH-═H2O | |
| C. | 碳酸钙与稀硝酸:CO32-+2H+═CO2↑+H2O | |
| D. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应---二氧化碳 | B. | 光化学烟雾---二氧化氮 | ||
| C. | 酸雨---二氧化碳 | D. | 臭氧层破坏---氟氯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2晶体中共含有4NA个离子 | |
| B. | 0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| C. | 常温常压下16gO2和O3混合气体含有NA个氧原子 | |
| D. | 1mol/LNa2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅 | B. | 机油 | C. | 三氯化锑 | D. | 硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
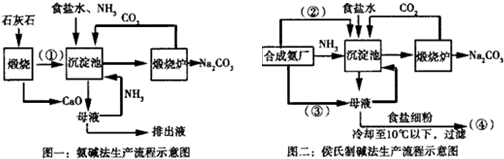
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com