
分析 NO2和O2混合气体与反应可能的反应式有:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,根据反应的方程式利用讨论的方法进行计算原混合气体中NO2和O2的体积.
解答 解:若氧气过量,则剩余5mL气体为氧气,设参加反应的氧气的体积为x,则:
4NO2+O2+2H2O=4HNO3
4x x
4x+x=30mL-5ml=25mL,
x=5ml,所以氧气的体积为:5ml+5ml=10mL,二氧化氮体积为:30mL-10mL=20mL;
则剩余5mL气体为NO,设氧气的体积为y,
4NO2+O2+2H2O=4HNO3
4y y
3NO2+H2O=2HNO3+NO
3 1
(30mL-y-4y) 5mL
y=3mL,
则氧气体积为3mL,二氧化氮体积为:30mL-3mL=27mL,
答:若氧气过量,氧气的体积为10mL、二氧化氮体积为20mL;若NO2过量,氧气体积为3mL,二氧化氮体积为27mL.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 从铁、铝合金出发的反应如图所示:
从铁、铝合金出发的反应如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.3g | B. | 6.9g | C. | 16.1g | D. | 18.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
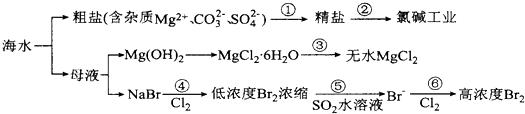
| A. | 过程①的提纯是化学过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O直接灼烧得不到MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24LCl2 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com