
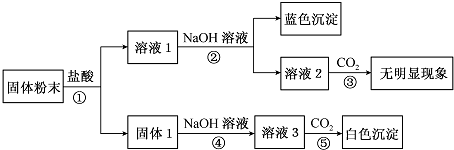
分析 固体粉末中可能含有SiO2、Na2O、Ca0、Cu0、Fe203,加入盐酸,可以和盐酸反应的是Na2O、Ca0、Cu0、Fe203,SiO2和盐酸之间不反应,所以固体1是二氧化硅,可以和氢氧化钠之间反应得到硅酸钠溶液,向其中通入二氧化碳,可以得到硅酸白色沉淀,溶液1可以和氢氧化钠之间反应得到蓝色的氢氧化铜沉淀,所以固体中一定含有Cu0,一定不存在Fe203,溶液2中一定不含氢氧化钙,所以固体混合物一定不含Ca0,无法判断是否存在氧化钠.
解答 解:固体粉末中可能含有SiO2、Na2O、Ca0、Cu0、Fe203,加入盐酸,可以和盐酸反应的是Na2O、Ca0、Cu0、Fe203,SiO2和盐酸之间不反应,所以固体1是二氧化硅,可以和氢氧化钠之间反应得到硅酸钠溶液,向其中通入二氧化碳,可以得到硅酸白色沉淀,溶液1可以和氢氧化钠之间反应得到蓝色的氢氧化铜沉淀,所以固体中一定含有SiO2、Cu0,一定不存在Fe203,溶液2中一定不含氢氧化钙,所以固体混合物一定不含Ca0,无法判断是否存在氧化钠,综上分析得到:固体中一定含有SiO2、Cu0,一定不存在Ca0、Fe203,无法判断是否存在氧化钠.
(1)步骤②中生成蓝色沉淀的离子方程式为:Cu2++2OH-=Cu(OH)2↓,故答案为:Cu2++2OH-=Cu(OH)2↓;
(2)硅酸钠溶液中通入二氧化碳,可以得到硅酸白色沉淀,步骤⑤中生成的白色沉淀是硅酸H2SiO3,故答案为:H2SiO3;
(3)根据实验现象,固体粉末中一定存在的组分是SiO2、Cu0,故答案为:SiO2、Cu0.
点评 本题考查了物质检验方法的分析判断,物质性质的应用,掌握基础是关键注意物质和离子性质和反应现象的分析判断题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.
草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 含有大量H+的溶液中:Na+、Fe2+、NO3-、SO42- | |
| C. | 某无色溶液中:Na+、Al3+、Cl-、HCO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol•L-1的无色溶液中:K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NO3-、CO32-、Cl-一定能够大量共存 | |
| C. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 1 L0.1 mol•L-1FeCl3溶液和足量的Zn充分反应,生成11.2 g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
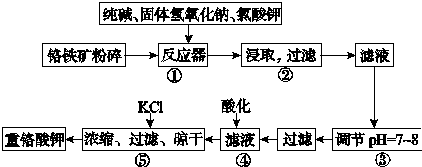
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com