
| W | X | Y | ||
| R | Z |
 .
.| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
分析 R为地壳中含量最多的金属元素,则R为Al,可推知W为C、X为N、Y为O、Z为Cl.
(1)Z为Cl元素,原子核外有17个电子,有3个电子层,各层电子数为2、8、7;
(2)W与氢原子形成6原子分子为C2H4,分子中碳原子之间形成2对个用电子式;
(3)Al2O3、N2、C在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1,应生成AlN与CO;
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物为NH4NO3,溶液中NH4+离子水解,溶液呈酸性;
(5)肼和N2O4发生反应:2N2H4+N2O4=3N2+4H2O,根据盖斯定律书写目标热化学方程式;
(6)根据K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{3})}$计算平衡常数,再计算浓度商Qc,与平衡常数相比判断反应进行方向,进而确定v(正)、v(逆)相对大小.
解答 解:R为地壳中含量最多的金属元素,则R为Al,可推知W为C、X为N、Y为O、Z为Cl.
(1)Z为Cl元素,原子核外有17个电子,原子结构示意图为: ,
,
故答案为: ;
;
(2)W与氢原子形成6原子分子为C2H4,分子中碳原子之间形成2对个用电子式,结构简式为:CH2=CH2,
故答案为:CH2=CH2;
(3)Al2O3、N2、C在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1,应生成AlN与CO,反应的化学方程式为:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,
故答案为:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物为NH4NO3,溶液中NH4+离子水解,溶液呈酸性,故溶液中离子浓度大小顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(5)已知①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
由盖斯定律,②×2-①可得:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ/mol;
(6)平衡时PCl3为0.2mol,则:
PCl5(g)?PCl3(g)+Cl2(g),
开始(mol):1 0 0
转化(mol):0.2 0.2 0.2
平衡(mol):0.8 0.2 0.2
则平衡常数K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{3})}$=$\frac{\frac{0.2}{2}×\frac{0.2}{2}}{\frac{0.8}{2}}$=0.025,
相同温度下,起始时向容器中充入1.00mol PC15、0.20mol PCl3和0.40mol Cl2,则Qc=$\frac{0.1×0.2}{0.5}$=0.04>K=0.025,所以反应向逆反应进行,故v(正)<v(逆),
故答案为:<.
点评 本题考查元素周期表、化学方程式书写、离子浓度大小比较、热化学方程式书写、平衡常数应用等,是对学生综合能力的考查,(6)中注意根据浓度商与平衡常数关系判断反应进行方向.


科目:高中化学 来源: 题型:解答题
 (1)利用原电池原理做如下实验:将一块白铁(镀锌)和一块马口铁(镀锡)上用小刀各划一道刻痕,露出里面的铁,向刻痕上各滴一滴NaCl溶液后,再各滴一滴K3[Fe(CN)6]溶液,放置在空气中,约10分钟观察到有一刻痕变蓝色.回答下列问题:
(1)利用原电池原理做如下实验:将一块白铁(镀锌)和一块马口铁(镀锡)上用小刀各划一道刻痕,露出里面的铁,向刻痕上各滴一滴NaCl溶液后,再各滴一滴K3[Fe(CN)6]溶液,放置在空气中,约10分钟观察到有一刻痕变蓝色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
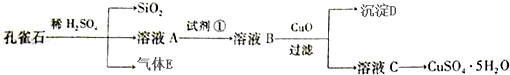
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对溶液所在体系加热,溶液蓝色加深 | |
| B. | 对溶液所在体系用冰水降温,上述反应的平衡常数减小 | |
| C. | 室温下,加水稀释至一定范围,溶液为蓝色 | |
| D. | 室温下,加水稀释至一定范围,溶液为粉红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使红色石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol | B. | 0.03mol | C. | 0.04mol | D. | 0.01~0.03mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,V正、V逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数 | |
| C. | 降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数 | |
| D. | 增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆增大倍数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com