
| A. |  装置中阳极上析出红色固体 | |
| B. |  装置的待镀铁制品应与电源负极相连 | |
| C. |  装置中粗铜应与电源负极相连 | |
| D. | 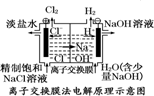 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
分析 A、电解池的阳极是电解质中的阴离子失电子的过程;
B、根据电镀原理来回答判断;
C、根据精炼铜装置原理,粗铜作阳极,精铜作阴极判断;
D、离子交换膜是阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过.
解答 解:A、装置①中阳极上是电解质中的氯离子失电子生成氯气的过程,所以不会有红色物质析出,故A错误;
B、在电镀池中,镀件金属应该做阴极,镀层金属做阳极,所以待镀铁制品应做阴极,与电源负极相连,故B正确;
C、精炼铜装置原理,粗铜作阳极,精铜作阴极,所以粗铜应与电源正极相连,故C错误;
D、阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过,避免阳极生成的氯气和阴极生成的氢氧根离子反应,故D错误.
故选B.
点评 本题考查学生原电池和电解池的工作原理知识,可以根据教材知识来回答,注意平时知识的积累是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是三种不同核素,互称为同位素,都属于氢元素 | |
| C. | X、Y两种元素的简单离子具有相同的电子层结构,则核电荷数大的元素离子半径小 | |
| D. | 18O中质子数与中子数不相等,但其和为18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 卤素原子半径逐浙减少 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
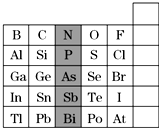 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大,平衡左移 | |
| B. | 加压,正反应速率增大,逆反应速率减小 | |
| C. | 温度、体积不变,充入He气加压,反应速率加快 | |
| D. | 升温,混合气平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOC2H5 CH3CH2COOH | B. | 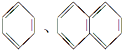 | ||
| C. | O2、O3 | D. | H、D、T |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com